Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión impresa ISSN 0004-0584versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.88 no.1 Montevideo feb. 2017
Incidencia del síndrome de abstinencia
en niños críticamente enfermos
Incidence of withdrawal syndrome in critically ill children
Marina Burastero1, Héctor Telechea2, Sebastián González3, Alicia Manassi4, Paula Mendez4, Mabel Brunetto4, Amanda Menchaca5
1. Pediatra. Intensivista. Facultad de Medicina. UDELAR.
2. Prof. Adj. UCIN. Prof. Adj. Farmacología. Facultad de Medicina. UDELAR.
3. Asistente UCIN. Facultad de Medicina. UDELAR.
4. Lic. Enf. UCIN. Facultad de Medicina. UDELAR.
5. Prof. Dra. UCIN. Facultad de Medicina. UDELAR.
UCIN. CHPR. Facultad de Medicina. UDELAR. ASSE.
Trabajo inédito.
Declaramos no tener conflictos de interés.
Fecha recibido: 13 de julio de 2016
Fecha aprobado: 19 de setiembre de 2016
Resumen
Objetivo: determinar la incidencia del síndrome de abstinencia (SA), describir presentación clínica e identificar la presencia de factores de riesgo.
Metodología: se realizó un estudio prospectivo, observacional, de evaluaciones reiteradas usando la Sophia Observation Withdrawal Symptoms Scale (SOWS), en la Unidad de Cuidado Intensivo de Niños (UCIN) de 20 camas, del Centro Hospitalario Pereira Rossell (CHPR). Se incluyeron los niños ingresados en UCIN entre el 1 de noviembre de 2013 y el 30 de setiembre de 2014 tratados con benzodiacepinas y/o opiáceos por cinco días o más. Se registró: duración de la estadía, fármacos utilizados para sedación y analgesia, días de uso, máximo de dosis, dosis total acumulada. El diagnóstico de SA se realizó a través del uso de la SOWS. Los pacientes fueron divididos en dos grupos, con y sin SA. Se analizaron y compararon las características de ambos grupos.
Resultados: se incluyeron 39 niños. La incidencia de SA fue 18% (7/39). Los ítems del SOWS más frecuentes fueron ansiedad y sueño menor a 1 hora. Los niños que desarrollaron SA presentaron dosis acumulativas más elevadas tanto de midazolam (54,1 mg/kg vs 44,2 mg/kg) como de fentanilo (464,2 mg/kg vs 380,1 mg/kg).
Conclusiones: el SA fue frecuente en este grupo de niños. Las dosis acumulativas fueron mayores en el grupo con SA. La SOWS es una herramienta útil y de fácil aplicación para el diagnóstico de SA.
Palabras clave: SÍNDROME DE ABSTINENCIA
A SUSTANCIAS
ENFERMEDAD CRÍTICA
INCIDENCIA
NIÑO
Summary
Objective: The study aims to determine the incidence of withdrawal syndrome, its clinical features and the presence of risk factors.
Methodology: An observational and prospective study. Assessment was repeated and the Sophia Observation Withdrawal Symptoms Scale (SOWS) was used. The study was conducted at the Pediatric Intensive Care Unit (PICU) of Centro Hospitalario Pereira Rossell (CHPR). Hospitalized children in PICU between 1/11/2013- 30/9/2014 and treated with benzodiazepines and opioids during 5 days or more were included in the study. Days of stay at the PICU, agents used for sedation (dose, duration) and cumulative doses were recorded. Withdrawal syndrome diagnosis was done using the SOWS.
Results: 39 children were included in the study. The incidence of withdrawal syndrome was 18% (7/39). Children who developed withdrawal syndrome presented higher cumulative doses of midazolam (54.1 mg/kg vs. 44.2 mg/kg) and fentanyl (464.2µg/kg vs. 380.1 µg/kg) than those without withdrawal syndrome.
Conclusions: the withdrawal syndrome was frequent in this population. Cumulative doses of midazolam and fentanyl were higher in those with withdrawal symptoms. The SOWS is a useful resource for diagnosis.
Key words: SUBSTANCE WITHDRAWAL SYNDROME
CRITICAL ILLNESS
INCIDENCE
CHILD
Introducción
La sedación y analgesia son uno de los pilares del tratamiento de los niños críticamente enfermos, para disminuir la respuesta al estrés, evitar la extubación accidental, el retiro de accesos vasculares y lograr la adaptación a la asistencia ventilatoria mecánica (AVM)(1-6). Los grupos más frecuentemente utilizados son las benzodiacepinas (BZD) y los opioides. Ambos generan dependencia física en la administración continua o por períodos prolongados(7,8). La sobresedación y la infrasedación son frecuentes en las Unidades de Cuidados Intensivos Pediátricos (UCIP). La sobresedación determina mayor estadía en UCIP y riesgo de síndrome de abstinencia (SA)(9).
El SA se define como el conjunto de signos y síntomas que se manifiestan al discontinuar o descender la dosis opioides y/o BZD(7). Las manifestaciones del SA dependen de muchos factores: fármaco, edad, estado cognitivo(7,8). El riesgo de SA es mayor con la administración en infusión continua y con opioides sintéticos (fentanilo) que con morfina(10). El uso de bloqueantes neuromusculares (BNM) concomitante puede aumentar el riesgo de SA(10). Las infusiones prolongadas, dosis acumulativas elevadas y la discontinuación brusca son los principales factores de riesgo para el SA(11,12). Dosis acumulativas de midazolam 60 mg/kg y de fentanilo 1,5 mg/kg se asocian con el SA(11,13). La incidencia de SA en las UCIP tiene una prevalencia variable entre 35%-57%(11,13,14). El diagnóstico de SA es dificultoso, ya que sus síntomas y signos se solapan con entidades frecuentes en UCIP(15,16). No existe un gold standard para el diagnóstico y es necesaria una alta sospecha clínica(4,17,18). El momento de aparición del SA depende de la vida media de eliminación, siendo temprano en aquellos de vida media corta o días más tarde si el agente o sus metabolitos tienen vida media larga(19,20). La sintomatología del SA se produce por sobreestimulación de sistema nervioso central, disturbios gastrointestinales y disregulación autonómica(21). Dado lo proteiforme de la clínica, es necesario un sistema de evaluación para el mismo(16). Ista y colaboradores desarrollaron el Sophia Observation Withdrawal Symptoms Scale (SOWS), que ha presentado adecuado rendimiento para el diagnóstico de SA en niños y ha sido desarrollado para su uso en lactantes y niños mayores(22,23). Esta escala incluye 15 ítems (tabla 1). El presente estudio se realizó con el objetivo de determinar la incidencia de SA secundario al uso de opioides y BZD en la Unidad de Cuidados Intensivos de Niños (UCIN) del Centro Hospitalario Pereira Rossell (CHPR). Los objetivos secundarios fueron identificar los factores de riesgo presentes para el desarrollo de SA.
Pacientes y métodos
Se realizó un estudio prospectivo, observacional de evaluaciones reiteradas con la SOWS. El mismo se realizó en la UCIN del CHPR. Este es el centro de referencia nacional materno-infantil en Uruguay. UCIN es una UCIP polivalente que cuenta con ocho camas de cuidados intensivos y 12 de cuidados intermedios. Se incluyeron los niños ingresados entre el 1 noviembre de 2013 hasta el 30 de setiembre de 2014 y que recibieron BZD y/o opiáceos por cinco días o más. Se excluyeron aquellos con enfermedad neurológica subyacente previa y estado de mal convulsivo tratado con BZD. Para valorar la presencia del SA se aplicó el SOWS. Luego del comienzo del destete o la suspensión de los opioides y BZD, se realizaron dos evaluaciones diarias (cada 12 horas), por 72 horas o hasta el alta de UCIN si ésta se produjo previo a las 72 horas. Cuando se realizó diagnóstico de SA por el SOWS, no se realizaron más observaciones en dicho paciente.
Se consideró que el destete comenzó el día que la dosis de opioides o BZD se redujo 10% o más. La SOWS fue aplicada por integrantes del equipo médico y de enfermería. En cada una de las observaciones se chequearon los 15 ítems y se marcaron presentes o ausentes, en las 12 horas previas de iniciado el destete o de la observación previa. Los ítems presentes se puntearon con valor de 1, y los ausentes 0. El score total resultó de la suma de todos los valores (mínimo 0, máximo 15). Para el diagnóstico de SA se consideró un puntaje = ó > 4(15). Se consignó la modalidad de destete (interrupción brusca o discontinuación escalonada) y duración del destete. Se registraron datos adicionales (edad, sexo, estadía en UCIN y duración de AVM). Se utilizó el escore predictor de Mortalidad al ingreso 'PIM
Resultados
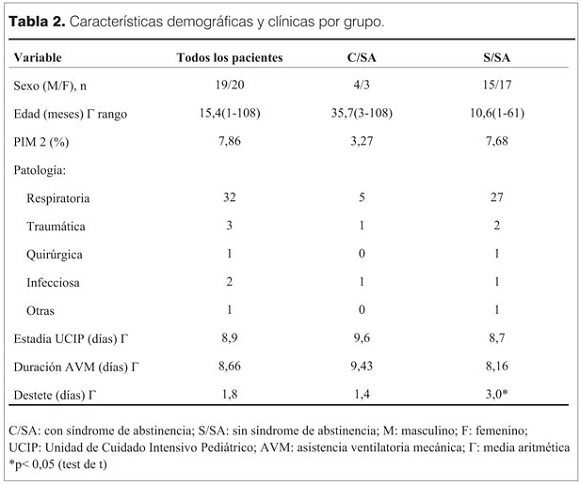
De los 573 pacientes que ingresaron en UCIN durante el período de realización del estudio, 39 cumplieron los criterios de inclusión. Los 39 requirieron AVM. De éstos, 38 recibieron la asociación de midazolam con fentanilo y uno recibió únicamente fentanilo. Presentaron puntaje = ó > 4 en el SOWS siete de los 39, con una incidencia de SA de 18%. En los siete pacientes con SA se realizaron 32 evaluaciones y los ítems del SOWS más frecuentes identificados fueron: ansiedad y sueño menor de una hora, presentándose cada uno de ellos en 14 evaluaciones de las 32. En orden de frecuencia le siguieron taquicardia (10/32), fiebre (9/32) llanto, taquipnea (8/32), polipnea (7/32), diarrea (6/32), vómitos (3/32). Las principales características de ambos grupos se presentan en la tabla 2.
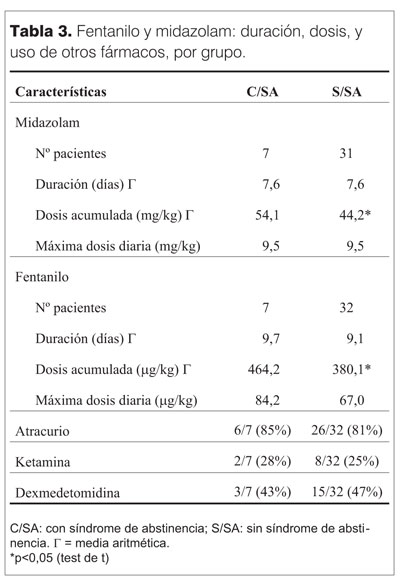
La mediana de la edad del total de la población fue 5 meses. En el grupo con SA fue 19 meses y 4 meses en los que no desarrollaron SA. La principal causa de internación fue la patología respiratoria en ambos. Si bien la estadía en UCIP y la duración de la AVM no presentaron diferencias de significación estadística, si se observó una tendencia a mayor duración de estadía y AVM en el grupo con SA (tabla 2). Las características en el uso de midazolam, fentanilo y otros fármacos se muestran en la tabla 3. En relación a las BZD, los pacientes de ambos grupos recibieron midazolam, por igual tiempo (media 7,5 días). En el grupo con SA la dosis acumulativa fue mayor (media 54,1 mg/kg vs 44,2 mg/kg) (p<0,05). La dosis máxima no presentó diferencias significativas. En relación a fentanilo, la duración del uso fue similar en los dos grupos, la media de las dosis acumulativa fue 464,2 mg/kg en el grupo con SA vs 380,1 mg/kg en niños sin SA (p<0,05). El máximo de dosis de fentanilo, fue mayor en niños con SA, pero esta diferencia no fue significativa. La duración de la infusión de midazolam y fentanilo fue similar en ambos grupos (tabla 3). Se usaron en forma concomitante con fentanilo y midazolam otros fármacos. Estos fueron atracurio y ketamina, en un porcentaje similar en los dos grupos (tabla 3).
Para el destete se utilizó dexmedetomidina también en un porcentaje similar (tabla 3). En cuanto a la duración promedio del destete, fue menor en el grupo con SA, 1,71 días vs 3,0 días en el grupo sin SA (p<0,05). Luego de la suspensión total de las drogas, los pacientes que más tempranamente manifestaron SA, lo hicieron a las 10 h.
Discusión
El SA es una complicación resultante de un desbalance entre la necesidad de mantener al niño confortable en la etapa más crítica de su enfermedad y los efectos de los fármacos requeridos para lograr este confort. La evidencia disponible para caracterizarlo es escasa, como muestra una revisión sistemática reciente(25). La nuestra constituye la primera experiencia nacional sobre la incidencia de SA en niños hospitalizados en una UCIP. En esta oportunidad se observó una incidencia de SA de 18%. Otros autores han reportado valores entre 35 y 57%, con el uso de opioides y BZD en forma conjunta(12,13). Esta diferencia probablemente sea multifactorial por el uso de diferentes estrategias en el tratamiento sedo-analgésico y en el destete; diferencias en el diseño del estudio, o al uso de diferentes escalas para el diagnóstico del SA. En esta oportunidad no se incluyeron niños que recibieron infusiones por menos de 5 días, que pueden haber desarrollado SA. A su vez en otros estudios se ha utilizado la Escala de Finnegan para el diagnóstico de SA, lo cual puede determinar diferencias en la incidencia(26). Esta muestra presentó mayoría de niños en el rango etario de
Conclusiones
El SA fue frecuente en este grupo de niños. Las dosis acumulativas fueron elevadas en el grupo con SA. La SOWS es una herramienta útil y de fácil aplicación para el diagnóstico de SA. Es esencial el uso de escalas para lograr un diagnóstico temprano y certero del SA.
Referencias bibliográficas
1. Howard R. Current status of pain management in children. JAMA 2003; 290(18):2464-9.
2. Middleton C. Understanding the physiological effects of unrelieved pain. Nurs Times 2003; 99(37):28-31.
3. Anand K. Relationship between stress responses and clinical outcome in newborns, infants, and children. Crit Care Med 1993; 21(9):S358-9.
4. Playfor S, Jenkins I, Boyles C, Choonara I, Davies G, Haywood T, et al; United Kingdom Paediatric Intensive Care Society Sedation; Analgesia and Neuromuscular Blockade Working Group. Consensus guidelines on sedation and analgesia in critically ill children. Intensive Care Med 2006; 32(8):1125-36.
5. da Silva P, de Aguiar V, Neto H, de Carvalho W. Unplanned extubation in a paediatric intensive care unit: impact of a quality improvement programme. Anaesthesia 2008; 63(11):1209-16.
6. Anand K, Hansen D, Hickey P. Hormonal-metabolic stress responses in neonates undergoing cardiac surgery. Anesthesiology 1990; 73(4):661-70.
7. Tobias JD. Tolerance, withdrawal, and physical dependency after long-term sedation and analgesia of children in the pediatric intensive care unit. Crit Care Med 2000; 28(6):2122-32.
8. Arnold JH, Truog R, Scavone JM, Fenton T. Changes in the pharmacodynamics response to fentanyl in neonates during continuous infusion. J Pediatr 1991; 119(4):639-43.
9. Vet N, Ista E, de Wildt S, van Dijk M, Tibboel D, de Hoog M. Optimal sedation in pediatric intensive care patients: a systematic review. Intensive Care Med 2013; 39(9):1524-34.
10. Cammarano W, Pittet JF, Weitz S, Schlobohm R, Marks JD. Acute withdrawal syndrome related to the administration of analgesic and sedative medications in adult intensive care unit patients. Crit Care Med 1998; 26(4):676-84.
11. Fonsmark L, Rasmussen Y, Carl P. Occurrence of withdrawal in critically ill sedated children. Crit Care Med 1999; 27(1):196-9.
12. Hughes J, Gill A, Leach H, Nunn A, Billingham I, Ratcliffe J, et al. A prospective study of the adverse effects of midazolam on withdrawal in critically ill children. Acta Paediatr 1994; 83(11):1194-9.
13. Katz R, Kelly H, Hsi A. Prospective study on the occurrence of withdrawal in critically ill children who receive fentanyl by continuous infusion. Crit Care Med 1994; 22(5):763-7.
14. Anand K, Willson D, Berger J, Harrison R, Meert K, Zimmerman J, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development Collaborative Pediatric Critical Care Research Network. Tolerance and withdrawal from prolonged opioid use in critically ill children. Pediatrics 2010; 125(5):e1208-25.
15. Sury MR, Billingham I, Russell G, Hopkins C, Thornington R, Vivori E. Acute benzodiazepine withdrawal syndrome after midazolam infusions in children. Crit Care Med 1989; 17(3):301-2.
16. Ista E, van Dijk M, Gamel C, Tibboel D, de Hoog M. Withdrawal symptoms in critically ill children after long-term administration of sedatives and/or analgesics: a first evaluation. Crit Care Med 2008; 36(8):2427-32.
17. Ista E, van Dijk M, Gamel C, Tibboel D, de Hoog M. Withdrawal symptoms in children after long-term administration of sedatives and/or analgesics: a literature review. “Assessment remains troublesome”. Intensive Care Med 2007; 33(8):1396-406.
18. Franck L, Harris S, Soetenga D, Amling JK, Curley MA. The Withdrawal Assessment Tool-1 (WAT-1): an assessment instrument for monitoring opioid and benzodiazepine withdrawal symptoms in pediatric patients. Pediatr Crit Care Med 2008; 9(6):573-80.
19. Cunliffe M, McArthur L, Dooley F. Managing sedation withdrawal in children who undergo prolonged PICU admission after discharge to the ward. Paediatr Anaesth 2004; 14(4):293-8.
20. Anand K, Ingraham J. Pediatric tolerance, dependence, and strategies for compassionate withdrawal of analgesics and anxiolytics in the pediatric ICU. Crit Care Nurse 1996; 16(6):87-93.
21. Franck L, Naughton I, Winter I. Opioid and benzodiazepine withdrawal symptoms in paediatric intensive care patients. Intensive Crit Care Nurs 2004; 20(6):344-51.
22. Ista E, van Dijk M, de Hoog M, Tibboel D, Duivenvoorden H. Construction of the Sophia Observation withdrawal Symptoms-scale (SOS) for critically ill children. Intensive Care Med 2009; 35(6):1075-81.
23. Ista E, de Hoog M, Tibboel D, Duivenvoorden H, van Dijk M. Psychometric evaluation of the Sophia Observation withdrawal symptoms scale in critically ill children. Pediatr Crit Care Med 2013; 14(8):761-9.
24. Flórez J. Fármacos analgésicos opioides. En: Flórez J, Armijo J, Mediavilla A. Farmacología humana. Barcelona: Elsevier-Masson, 2008:523-42.
25. Best K, Boullata JI, Curley MA. Risk factors associated with iatrogenic opioid and benzodiazepine withdrawal in critically ill pediatric patients: a systematic review and conceptual model. Pediatr Crit Care Med 2015; 16(2):175-83.
26. Fernández F, Gabioli M, González R, Gómez P, Fernández S, Murga V, et al. Síndrome de abstinencia en cuidados intensivos pediátricos: incidencia y factores de riesgo. Med Intensiva 2012; 37(2):67-74.
27. Valdivielso A, Grupo de Trabajo de Analgesia y Sedación de la SEMICYUC. Analgesia, sedación y relajación en el niño con ventilación mecánica. Med Intensiva 2008; 32(supl 1):115-24.
28. Bernal J, Sandoval L, Tombe L, Hernández N. Método de destete en pacientes pediátricos ventilados mecánicamente en una unidad de cuidado intensivo de una clínica de cuarto nivel de la ciudad de Cali. ACCI 2012; 12(4):202-10.
29. Ista E, Tibboel D, van Dijk M. Opioid and benzodiazepine withdrawal syndrome: can we predict and prevent it? Pediatr Crit Care Med 2015; 16(2):195-6.
30. Best K, Asaro L, Franck L, Wypij D, Curley MA; Randomized Evaluation of Sedation Titration for Respiratory Failure Baseline Study Investigators. Patterns of sedation weaning in critically ill children recovering from acute respiratory failure. Pediatr Crit Care Med 2016; 17(1):19-29.
Correspondencia: Dr. Héctor Telechea.
Correo electrónico: hmteleo@gmail.com