Introducción
El carcinoma de tiroides es la neoplasia endocrina más frecuente y agrupa diferentes tipos de tumores con un comportamiento clínico y un pronóstico variable. Los tumores originados en las células foliculares representan más del 90 % de los casos y se conocen como carcinoma diferenciado de tiroides (CDT), que incluye el tipo papilar (85 % de estos cánceres) y el folicular (12 % de los cánceres).
Su incidencia ha aumentado exponencialmente en las últimas décadas. Esto puede reflejar un incremento real en la aparición del cáncer o, en su defecto, una mayor detección. Sin embargo, su tasa de mortalidad se mantiene baja1,2.
Datos de Vigilancia, Epidemiología y Resultados Finales (SEER) del Instituto Nacional del Cáncer muestran una tasa de nuevos casos de cáncer de tiroides de 13,5 por 100.000 hombres y mujeres por año (2017-2021), una tasa de mortalidad de 0,5 por 100.000 hombres y mujeres por año (2018-2022) y una supervivencia relativa a los 5 años del 98,4 % (2014-2020)3. En Uruguay, el cáncer de tiroides ocupa el quinto lugar en frecuencia en el sexo femenino, con una incidencia anual de 5 a 7 casos y una mortalidad de 0,33 por 100.000 habitantes (2015-2019)4.
Los avances en el conocimiento del cáncer de tiroides han propiciado un cambio de paradigma en su manejo, reflejado en las guías publicadas por la American Thyroid Association (ATA) en 2006, con sus actualizaciones en 2009 y 20145,6. Su tratamiento y seguimiento se mantienen en continua revisión, y se publican consensos sobre aspectos aún controversiales7.
Esto obliga a un proceso constante de actualización de los protocolos de actuación locales para aplicar criterios de valoración del riesgo de recidiva y mortalidad, permitiendo optimizar el seguimiento según los diferentes estadios y niveles de riesgo. Ampliar el conocimiento de la situación del CDT en nuestro medio puede ayudar a planificar y crear estrategias en la gestión clínica asistencial y de esta manera poder adaptar las guías globalmente conocidas a nuestra realidad8. En este sentido, diversas publicaciones y discusiones académicas interdisciplinarias han aportado información relevante sobre las características clínicas y los resultados obtenidos tras la aplicación de estas recomendaciones9–17.
Objetivo general:
proporcionar datos sobre las características, gestión y resultados del CDT en nuestra población, ampliando el conocimiento sobre nuestro presente.
Objetivo específico:
analizar las características clínicas del CDT y la respuesta al tratamiento realizado según la estratificación del riesgo de recurrencia (RR) inicial y dinámico de esta población.
Los datos se obtuvieron del campo de la medicina real (Real World Evidence) en pacientes atendidos en policlínicas de endocrinología de tres localidades del interior de nuestro país, cuyos diagnósticos se realizaron entre 2001 y 2020.
Pacientes y métodos
Se realizó un estudio de cohorte retrospectivo. En él se recopilaron los datos de las historias clínicas de pacientes mayores de 18 años con CDT (derivado del epitelio folicular: tipo histológico principal papilar o folicular). Dichos pacientes fueron diagnosticados por intervención quirúrgica entre el 1 de enero de 2001 y el 31 de diciembre de 2020 con un período mínimo de seguimiento de 12 meses.
Se incluyeron todos los pacientes atendidos en una policlínica de endocrinología de los departamentos de Rivera, Río Negro (ciudad de Young) y Soriano, en prestadores de salud públicos y privados. Los prestadores públicos fueron: Administración de los Servicios de Salud del Estado (ASSE), Hospital de Rivera, Hospital Regional Mercedes y Hospital de Young. Los prestadores privados fueron: Cooperativa de Asistencia Médica (CASMER), Cooperativa Médica de Rivera (COMERI), Cooperativa de Asistencia Médica Soriano (CAMS) y el Centro de Asistencia Médica de Young (CAMY). Estos prestadores cubren a más del 95 % de la población en sus respectivas localidades.
Los datos actualizados se registraron en una plantilla de Excel, incluyendo datos clínico-demográficos, descripción de tratamientos, variables anatomopatológicas, resultados de estudios de imagen y bioquímica. Esta información fue utilizada para recategorizar a los pacientes según su riesgo de recurrencia y se estableció el riesgo dinámico usando definiciones previamente publicadas y validadas por la ATA18 y Momesso et al19. (para pacientes no ablacionados).
Para su análisis, los datos fueron agrupados en quinquenios (2001-2005, 2006-2010, 2011-2015, 2016-2020).
Se excluyeron aquellos pacientes que tenían menos del 90 % de las variables a evaluar. También, aquellos con diagnóstico de neoplasia folicular de tiroides no invasiva con características nucleares de tipo papilar (NIFTP)20.
Variables analizadas
Características demográficas: sexo, edad.
Características relacionadas con el tumor al diagnóstico: la fecha del diagnóstico se estableció como la fecha de la intervención quirúrgica o la fecha de la punción aspiración con aguja fina (PAAF) del nódulo sospechoso en pacientes no intervenidos quirúrgicamente.
Tratamiento inicial: para la evaluación del procedimiento quirúrgico los autores adoptaron la siguiente clasificación.
Tiroidectomía total (TT) en uno y dos tiempos.
Tiroidectomía subtotal (lobectomía más subtotal contralateral).
Lobectomía (con o sin istmectomía).
Realización de linfadenectomía en el compartimento central (nivel VI) y en el compartimento lateral (niveles II, III, IV).
Tratamiento con 131I por quinquenios (actividad inicial, número de dosis utilizadas y actividad total empleada).
Características anatomopatológicas iniciales: tipo histológico principal (papilar o folicular), subtipo histológico (papilar clásico, variante folicular, variante agresiva: esclerosante difuso, células altas, columnar), tamaño tumoral (<10 mm, 11-15 mm, 16-40 mm, >40 mm), multifocalidad, afectación ganglionar y su extensión, afectación extratiroidea y su extensión, y presencia de metástasis a distancia.
Recategorización de pacientes según el riesgo de recurrencia (RR): utilizando los criterios de la ATA en sus guías de 2015. El riesgo de mortalidad se estableció mediante el sistema de estadificación de la American Joint Committee on Cancer/International Union Against Cancer (AJCC/UICC) 8.a edición (estadios TNM I, II, III, IV)21.
Recurrencia/persistencia: a lo largo del período de seguimiento, se evaluó la “recurrencia”, definida como el diagnóstico de enfermedad activa (bioquímica y/o estructural) tras un período sin evidencia de enfermedad, y la “persistencia”, cuando luego del tratamiento inicial (dentro de los seis meses) o tras tratamientos sucesivos no se observó remisión.
-
Evaluación y seguimiento: se utilizaron los criterios de estratificación dinámica propuestos por la ATA en 2015 para valorar la respuesta inicial y la situación final de los pacientes.
Para la evaluación inicial tras el tratamiento, se consideraron las mediciones de tiroglobulina (Tg), anticuerpos antitiroglobulina (aTg) y ecodoppler tiroideo realizados a los seis meses poscirugía.
Se establecieron las siguientes categorías:
Ausencia de enfermedad: pacientes sin evidencia clínica, bioquímica ni estructural del cáncer.
Persistencia de enfermedad estructural o bioquímica, incluyendo respuesta indeterminada.
En los pacientes no tratados con 131I, se aplicaron los criterios propuestos por Momesso et al19.
Ausencia de enfermedad - respuesta excelente: Tg bajo tratamiento con hormona tiroidea (TH) <0,2 ng/ml o estimulada <2 ng/ml con aTg negativos e imágenes negativas. En pacientes con lobectomía, Tg bajo TH <30 ng/ml.
-
Persistencia de enfermedad:
Respuesta indeterminada: Tg bajo TH entre 0,2 ng/ml y 5 ng/ml, Tg estimulada entre 2 y 10 ng/ml, o pacientes con niveles de aTg estables o en descenso con hallazgos inespecíficos en imágenes.
Bioquímica incompleta: Tg bajo TH >5 ng/ml o estimulada >10 ng/ml, o niveles de Tg o aTg en ascenso con niveles similares de TSH y con imágenes negativas. En pacientes con lobectomía, Tg bajo TH >30 ng/ml.
Estructural incompleta: evidencia de enfermedad loco-regional o metástasis a distancia.
Se consideró pérdida de seguimiento cuando el paciente diagnosticado no continuaba con el seguimiento activo en la institución. Estos fueron contactados para recabar información sobre su estado de salud al final del estudio.
Se registró el fallecimiento y su causa (CDT u otra causa).
El tiempo de seguimiento se documentó hasta la fecha del fallecimiento o la fecha de pérdida de seguimiento.
-
Medición de Tg y aTg:
A lo largo del tiempo se emplearon distintos test inmunométricos: Axsym de Abbott, Elecsys 2010 Roche, Cobas 411 y, finalmente, el método electroquimioluminiscente (ECLIA) Cobas e801 (Roche).
Sensibilidad analítica para Tg: 0,04 ng/ml; sensibilidad funcional: 0,1 ng/ml.
Medición de aTg mediante Elecsys Anti-Tg Cobas e801 (Roche). Se consideraron positivos valores >20 UI/ml.
-
Los pacientes se clasificaron en tres categorías según la presencia de aTg:
Tratamiento de la persistencia/recurrencia de la enfermedad: se registró el tratamiento elegido en cada caso (cirugía, radioyodo, radioterapia, inhibidores de tirosina cinasa, etc.).
-
Complicaciones posquirúrgicas:
Análisis estadístico
Los resultados se expresaron como media ± desviación estándar o medianas para variables cuantitativas, y como proporciones para variables cualitativas.
Para la comparación de variables cuantitativas de más de dos grupos se utilizó la prueba de ANOVA.
Para la comparación de variables cualitativas se empleó la prueba de chi-cuadrado de Pearson.
Para la valoración de los factores relacionados con la recurrencia se realizó un análisis de regresión logística binaria.
La supervivencia del CDT se calculó mediante el método de Kaplan-Meier.
El tiempo de seguimiento (mediana) se estimó por el método de Kaplan-Meier invertido.
Se estableció un nivel de significación estadística de p < 0,05.
El análisis estadístico se llevó a cabo con el software SPSS v22.0 (International Business Machines [IBM] Corporation).
Resultados
De un total de 137 pacientes con diagnóstico de CDT, se incluyeron 126 pacientes distribuidos por localidad de la siguiente manera: Soriano (75 pacientes), Rivera (40 pacientes) y Young (11 pacientes).
Once pacientes fueron excluidos: 9 por datos incompletos y 2 con diagnóstico de NIFTP20. La mediana de seguimiento fue de 7 años.
Las características demográficas e histológicas iniciales se presentan en la tabla 1. Durante el período de evaluación, se observó un aumento en el número de diagnósticos (tanto en hombres como en mujeres), a expensas del carcinoma papilar, mientras que la frecuencia del carcinoma folicular se mantuvo estable (Figura 1).
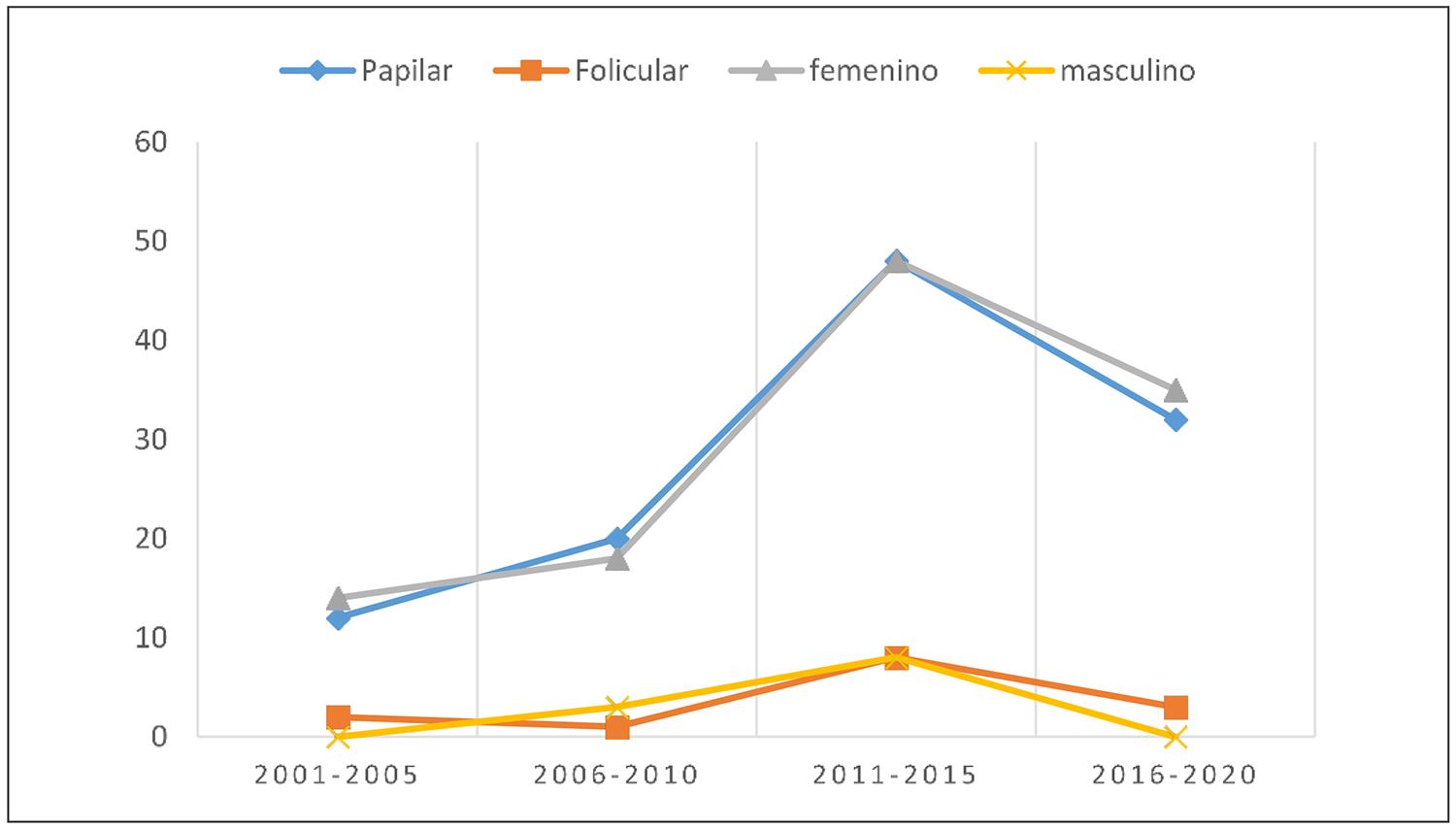
Figura 1. Número de pacientes diagnosticados por quinquenios según tipo histológico y sexo.Aumento del cáncer papilar en ambos sexos. Disminución del número de casos diagnosticados por año (2015-2019). Porcentaje de cambio anual estimado: −6,734.
Tabla 1. Características demográficas y presentación inicial de pacientes con CDT.

Las variables cuantitativas se expresan como media ± desviación estándar.
a N° de pacientes dentro de afectación ganglionar.
b N° de pacientes dentro de afectación extra tiroidea.
El tamaño del tumor se mantuvo estable, con una media de 18,6 mm ± 12,2 en los distintos quinquenios (Figura 2). La proporción de diagnósticos según el tamaño del tumor (<10 mm, 11-15 mm, 16-40 mm y >40 mm) no mostró diferencias significativas en el período analizado en los 126 pacientes (p = 0,9), ni en el análisis por localidades (p = 0,6).
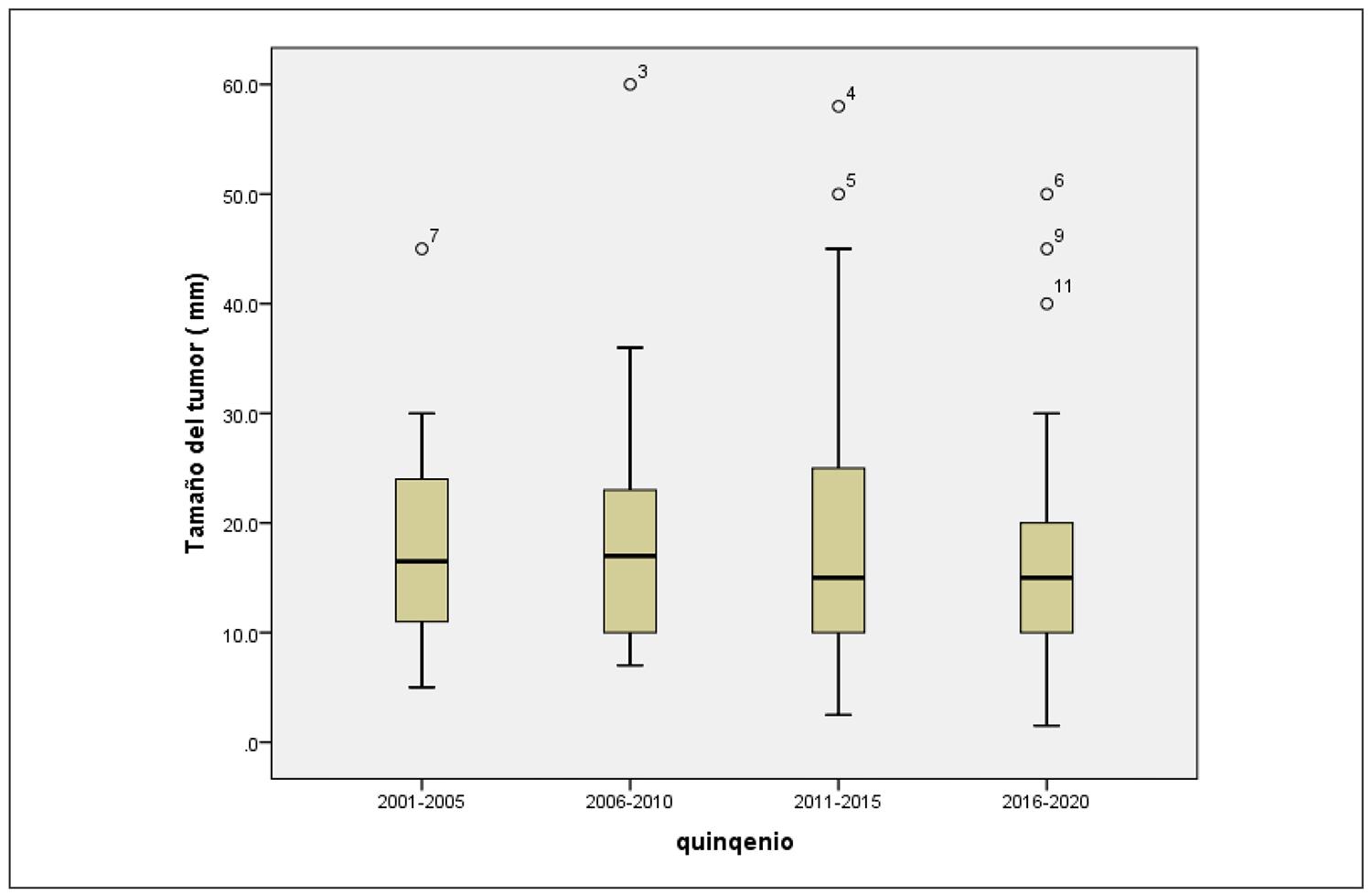
Figura 2. Tamaño tumoral por quinquenios.Mediana del tamaño tumoral diagnosticado para cada período.
La media de edad al diagnóstico fue de 45,12 ± 13,73 años, sin cambios significativos entre los quinquenios (p = 0,3).
De acuerdo con la clasificación TNM21, predominó el estadio I de la AJCC (92%), seguido del estadio II (6%), mientras que un paciente fue estadificado como IVB. Tres pacientes (2,3%) presentaron metástasis a distancia.
En cuanto a la calificación inicial del riesgo de recurrencia, 82 pacientes fueron clasificados con bajo riesgo de recurrencia (RR), mientras que 13 pacientes cumplieron criterios de alto RR debido a la presencia de metástasis a distancia, afección extratiroidea macroscópica o margen de resección positivo para tumor (Tabla 1).
Los datos del tratamiento realizado se muestran en la tabla 2. La tiroidectomía total fue el procedimiento inicial en 121 pacientes. La tiroidectomía total en dos tiempos se realizó en 34 casos, observándose una reducción de esta estrategia a lo largo de los años, pasando del 21% de los pacientes en 2001 al 11% en 2020 (p = 0,04).
Tabla 2. Resultados del tratamiento utilizado en la cohorte de CDT.


Las variables cuantitativas se expresan como media ± desviación estándar. 131I: radioyodo.
a N° de pacientes dentro de los que recibieron más de una dosis.
Una lobectomía se realizó en 4 pacientes, con predominio en el último quinquenio.
Se efectuó linfadenectomía en 59 pacientes, encontrándose metástasis en 22 de ellos. La afectación ganglionar se localizó en el compartimento central en 15 pacientes, mientras que en 7 pacientes se presentó en ambos compartimentos, central y lateral.
El porcentaje de hipoparatiroidismo definitivo fue del 6 % y el de parálisis del nervio recurrente definitivo del 1,5 %.
En 110 pacientes de la serie se realizó tratamiento con 131I tras la cirugía inicial, sin diferencias en su utilización a lo largo de los distintos quinquenios. Las actividades utilizadas inicialmente, el número de dosis y las actividades acumuladas se presentan en la tabla 2.
La figura 3 muestra las dosis de 131I administradas según el riesgo de recurrencia (RR) en cada quinquenio. Las actividades aplicadas de 31-100 mCi, 101-150 mCi y >150 mCi se relacionaron significativamente con el riesgo calculado: RR bajo (p = 0,02), RR medio (p < 0,0001) y RR alto (p < 0,0001), respectivamente. Una actividad inicial de 30 mCi predominó en pacientes de bajo RR en el último quinquenio. El número de dosis aplicadas de 101 a 150 mCi se redujo a lo largo del estudio (p = 0,02) (Figura 3).
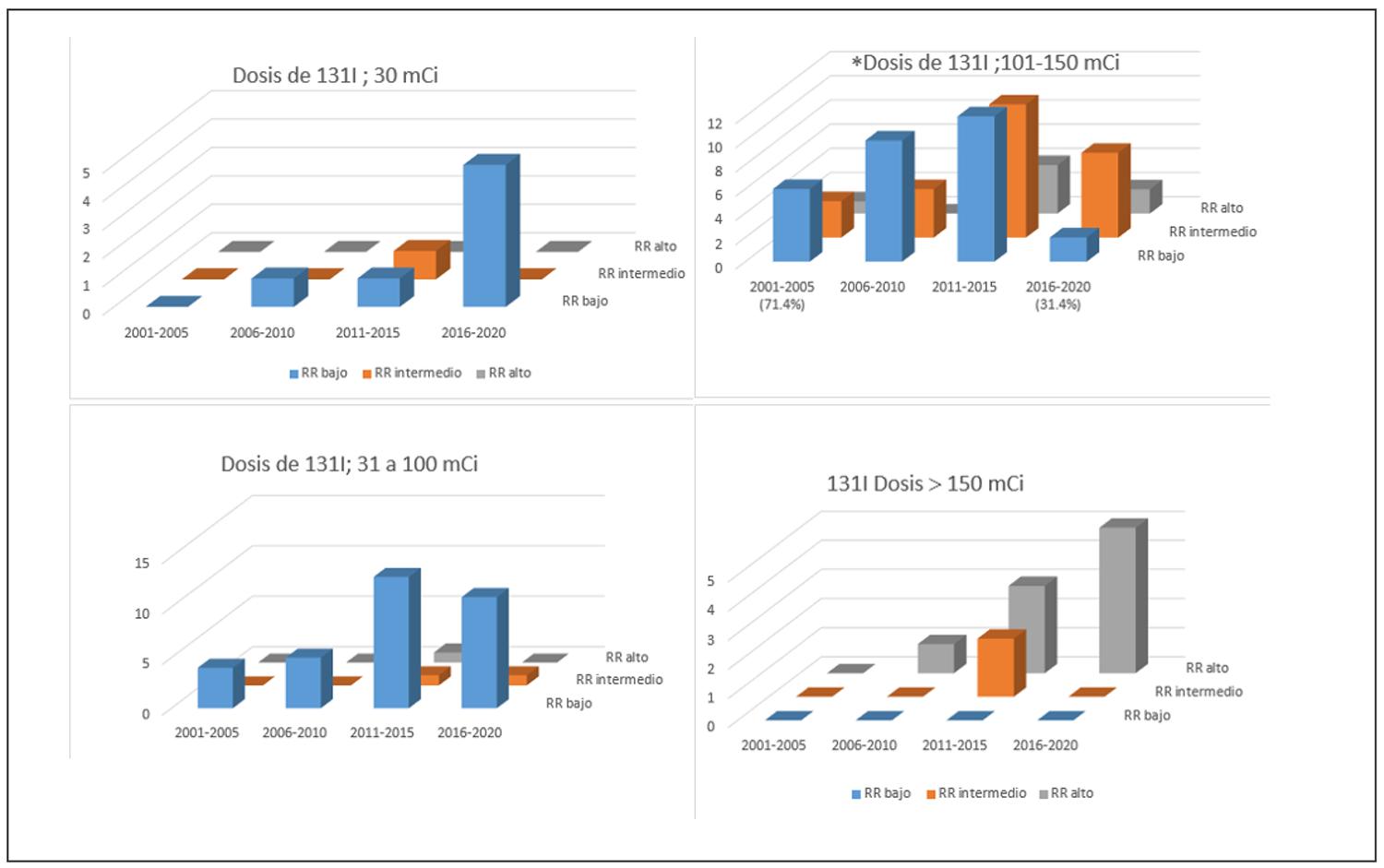
Figura 3. Dosis de 131I utilizadas por quinquenios en cada categoría de riesgo de recurrencia en pacientes con CDT.En los gráficos se muestran las dosis de 131I (mCi) utilizadas en cada categoría de RR, por quinquenio: 30; 31 a 100; 101 a 150 y >150. Las dosis fueron diferentes para cada categoría de RR (p< 0,05). Descenso significativo en el número de dosis aplicadas de 101 a 150 mCi (*p 0,02).
Un total de 11 pacientes recibieron más de una dosis. Las dosis acumuladas fueron <300 mCi en 5 pacientes y 300-600 mCi en 6 de ellos; no hubo dosis acumuladas mayores a 600 mCi.
De los 126 pacientes, 56 presentaron aTg positivo; de estos, 25 se volvieron negativos al finalizar la evaluación.
Al final del seguimiento, se documentó recurrencia en 9 pacientes y persistencia de la enfermedad en 5 pacientes, representando el 11 % de la cohorte estudiada.
No hubo recurrencia en la categoría de bajo RR, mientras que en las categorías de riesgo intermedio y alto, la tasa de recurrencia fue del 16,1 % y 30,8 %, respectivamente (p < 0,001).
Los factores que se asociaron de forma independiente con la recurrencia fueron la multifocalidad (p = 0,04) y la afectación ganglionar del compartimento lateral (p = 0,002) (Tabla 3).
Tabla 3. Factores relacionados de forma independiente con recurrencia/persistencia en la serie de CDT.
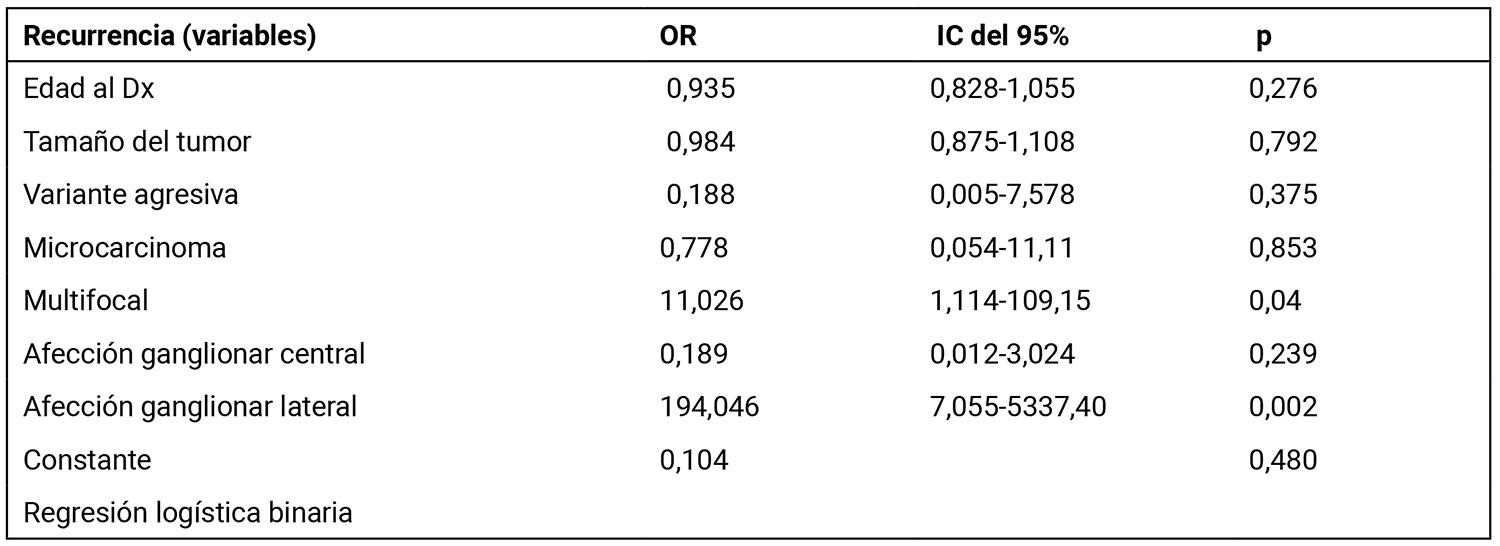
IC del 95%: intervalo de confianza del 95%; OR: odds ratio.
Tratamiento de la persistencia y recurrencia:
la recurrencia tumoral se presentó en adenopatías del compartimento lateral, niveles III y IV. En estos pacientes, el tratamiento consistió en cirugía seguida de una nueva dosis de 131I.
En los 5 casos de CDT con persistencia de la enfermedad (3,9 %), se realizó cirugía y radioyodo, y en 2 pacientes se administró radioterapia externa.
La supervivencia global del CDT en nuestra cohorte, con una mediana de seguimiento de 7 años, fue del 98 %. En la figura 4A se representa la probabilidad de supervivencia por cáncer de tiroides según las categorías AJCC-TNM 8.ª edición. No se presentaron pacientes en estadio III y hubo un paciente en estadio IVB.
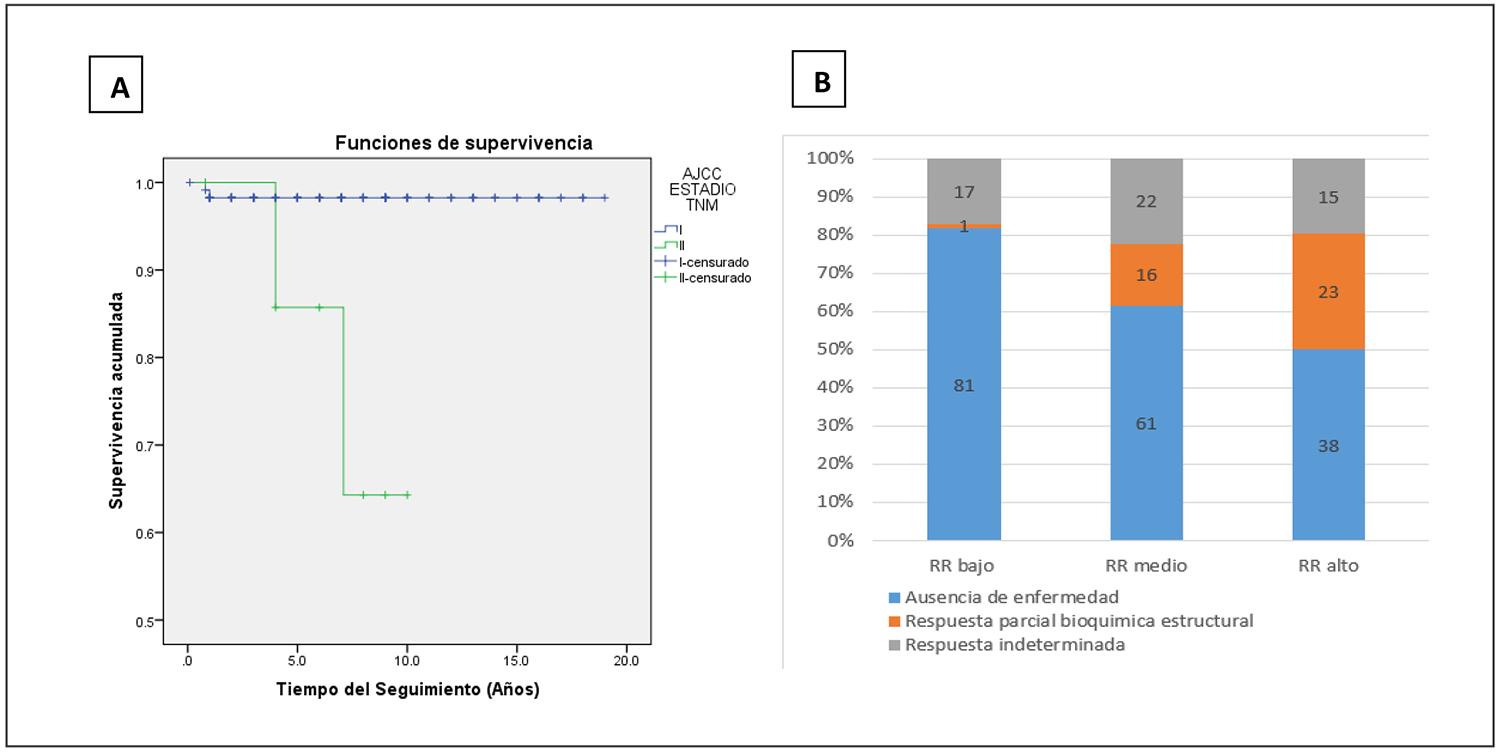
Figura 4. Gráfico de supervivencia por carcinoma diferenciado de tiroides (CDT) y situación clínica final de la población estudiada.A) Se representa la supervivencia global (Kaplan-Meyer) por estadios AJCC 8a edición, objetivándose una supervivencia del 98 % para el estadio I y del 64% para el estadio II.B) Situación final de los pacientes según categoría inicial de RR, utilizando los criterios de estratificación dinámica. El número de pacientes con ausencia de enfermedad, y respuesta parcial (bioquímica estructural) fue estadísticamente diferente para cada una de las categorías de riesgo inicial (p < 0,001).
Un paciente no fue operado y se sometió a vigilancia activa desde 2013 hasta el final del periodo de estudio. Se trató de una paciente de 74 años con una PAAF categoría VI del sistema Bethesda22 sobre un nódulo único de 10 mm de diámetro, en quien se optó, de común acuerdo, por el seguimiento clínico y por imágenes (ecografía y TC). Al cierre de la evaluación, continuaba con controles en otro prestador de salud.
Fallecieron cuatro pacientes en el periodo estudiado, dos de ellos por el proceso tumoral tiroideo (1,5 %), ambos en estadio II de la AJCC-TNM, con metástasis pulmonar. Su sobrevida fue de 4 y 7 años.
Al final del seguimiento, 91 pacientes se encontraban en la categoría de ausencia de enfermedad en remisión clínica, bioquímica y estructural; 22 presentaban una respuesta indeterminada por aTg positivo a título bajo; y 9 mostraban una respuesta incompleta, tanto bioquímica como estructural.
En la figura 4B se representa la situación final de la enfermedad en función de la estratificación inicial del riesgo de recurrencia. El número de pacientes en la categoría de ausencia de enfermedad fue estadísticamente diferente según la categoría de riesgo inicial: 67 pacientes en RR bajo, 14 en RR intermedio y 5 en RR alto (p < 0,001).
De forma similar, los pacientes con respuesta parcial bioquímica-estructural mostraron una asociación estadística significativa con el RR calculado: 1 paciente en RR bajo, 5 en RR intermedio y 3 en RR alto (p < 0,001).
La respuesta indeterminada no se relacionó con el RR.
El conjunto de datos que apoya los resultados de este estudio se encuentra disponible en el repositorio de datos de SciELO.
Discusión
En esta cohorte histórica retrospectiva, se recabaron los datos clínicos relevantes sobre el tratamiento y los resultados finales de todos los pacientes con diagnóstico de CDT atendidos en la policlínica de la especialidad durante un periodo de 20 años en prestadores de salud públicos y privados de estas localidades. Aunque el diseño del estudio no permite extraer datos epidemiológicos a gran escala, nuestros registros muestran un aumento en el número de diagnósticos durante el periodo evaluado, con características similares a las reportadas en estudios nacionales e internacionales1,4.
Un aspecto crítico de este trabajo es la representatividad de la cohorte analizada y la posibilidad de extrapolar nuestros resultados (validez externa). Para los departamentos de Soriano y Rivera, nuestros datos muestran una incidencia anual estimada de 8,6 nuevos casos por 100.000 habitantes en el sexo femenino en Soriano y de 3,2 por 100.000 en Rivera. Estas cifras son muy similares a las estadísticas del Instituto Nacional del Cáncer para ese género y esas regiones23,24. Esto sugiere un bajo riesgo de sesgo de selección en esta serie, lo que representa una fortaleza del estudio.
Las características clínico-demográficas de nuestra población se asemejan a las descritas en otras series1, con un predominio del tipo histológico papilar, mayor frecuencia en mujeres y una edad media al diagnóstico de 45 años. Los resultados finales muestran una tasa elevada de remisión de la enfermedad y una excelente supervivencia.
Se ha planteado que el aumento en el número de casos en países desarrollados se asocia a un sesgo de detección vinculado al uso de técnicas de imagen y a la realización posterior de PAAF, lo que ha llevado a un incremento en el diagnóstico de tumores pequeños (≤10 mm)25. En nuestra casuística, el aumento de los diagnósticos mostró una desaceleración en el último quinquenio (Figura 1), en concordancia con los datos del Registro Nacional del Cáncer que reporta una tendencia decreciente en el diagnóstico entre 2015 y 2019, tras un incremento del 9% anual en los cuatro años previos hasta 20144. Este cambio coincide con la implementación de las guías, donde la indicación de PAAFse restringe a nódulos sospechosos mayores de 1 cm.
Sin embargo, cabe destacar que el tamaño tumoral medio al diagnóstico en nuestra serie se mantuvo en 18 mm durante todo el periodo de observación (Figura 2). Esto sugiere la influencia de otros factores en el aumento de casos, como el acceso a la atención sanitaria, factores ambientales, dietéticos y moleculares1,2,26. Mientras tanto, la mortalidad global del CDT se ha mantenido estable, un hecho relevante que refuerza la necesidad de un enfoque multidisciplinario para el diagnóstico y tratamiento. Es fundamental identificar a los pacientes con mayor riesgo de recurrencia y/o mortalidad, diferenciándolos de aquellos con una evolución más indolente, para evitar el sobretratamiento. Esto pone de relieve la complejidad de la estratificación del riesgo preoperatorio, que depende de herramientas técnicas, la experiencia del cirujano y el informe anatomopatológico en cada centro. La evidencia actual sobre el impacto de la extensión de la cirugía en la supervivencia global, la indicación de tratamiento adyuvante con 131I y la eficacia de la cirugía de rescate ha tenido su mayor repercusión en la determinación de la cirugía inicial27. La Asociación Estadounidense de Cirujanos Endocrinos recomienda individualizar el tratamiento inicial de los CDT de 1 a 4 cm28.
Las características de alto riesgo, como antecedentes familiares de carcinoma de tiroides, irradiación previa del cuello, multifocalidad, extensión extratiroidea y afectación de ganglios linfáticos centrales y/o laterales del cuello justifican al menos una resección amplia (ATA). En pacientes de menor riesgo, las guías han respaldado un abordaje menos agresivo. En este sentido, se han propuesto estrategias como el seguimiento activo sin cirugía en pacientes seleccionados, tal como lo plantean Ito et al.14 y Sugitani et al29.
En nuestra serie, predominó la tiroidectomía total (TT) en el 96 % de los casos, con resección de ganglios linfáticos en el 46,8 % (n = 59) de los pacientes. Aunque en el último quinquenio se observó un modesto incremento en el número de lobectomías, sigue siendo una cirugía minoritaria. Se constató, además, un descenso en el número de pacientes en los que se completó la TT tras una hemitiroidectomía inicial, en contraste con otras observaciones30.
En los casos en los que se completó la TT luego de una hemitiroidectomía inicial (27 % de nuestros pacientes), los criterios utilizados por cada equipo quirúrgico incluyeron la indicación de terapia adyuvante con yodo radiactivo, la necesidad de seguimiento con Tg o la identificación de características de alto riesgo en la histología final. Es importante señalar que algunas variables utilizadas para la categorización del riesgo son exclusivamente histopatológicas y hasta un 40 % de los pacientes pueden ser reclasificados tras una hemitiroidectomía31,32, lo que influye en la decisión de completar la TT. Asimismo, la interpretación de las guías pudo haber variado entre los prestadores de salud, esto podría explicar las diferencias en la indicación de completar la TT.
En cuanto a la resección ganglionar, la estrategia ha evolucionado desde una linfadenectomía profiláctica sistemática hacia un abordaje más selectivo según los hallazgos intraoperatorios. La linfadenectomía terapéutica, tanto central como lateral, se ha mantenido sin cambios.
Destacamos que nuestra serie no mostró un mayor número de complicaciones relacionadas con procedmientos más radicales33, donde se reporta un 20 % de complicaciones en la tiroidectomía total (TT) frente a un 10,8 % en lobectomías34.
En nuestra cohorte, el hipoparatiroidismo permanente ocurrió en 8 pacientes (6 %) y la afectación permanente del nervio laríngeo en 2 pacientes (1,5 %), cifras similares a las reportadas en otras series35.
Aunque de forma moderada, las tendencias en el abordaje terapéutico de los pacientes con CDT han cambiado en los últimos 10 años. Estas variaciones influyeron en la decisión de realizar vigilancia activa36 en una paciente de 74 años.
La indicación de 131I tuvo como objetivos la ablación de remanentes, el tratamiento adyuvante y el manejo de la enfermedad persistente o recurrente. Idealmente, la indicación y la dosis deben adaptarse según el enfoque basado en el riesgo de recurrencia (RR), con un uso sistemático en pacientes de alto riesgo, selectivo en aquellos de riesgo intermedio y no indicado de rutina en los de bajo riesgo37,38.
El 87 % de nuestros pacientes ablacionados reflejan una alta frecuencia en la indicación del tratamiento, el cual, en la mayoría de los casos, estuvo dirigido al remanente tiroideo para facilitar el seguimiento. Tras la implementación de las guías de la ATA, se inició una selección más estricta de la indicación en pacientes con bajo RR, reflejando un cambio en nuestra práctica terapéutica. Aunque la administración de 131I continuó en todas las categorías de riesgo, la actividad administrada se correlacionó significativamente con el RR (Figura 3). Se observó, además, una reducción en las dosis de 101 a 150 mCi a lo largo del estudio (p < 0,001), especialmente en pacientes con RR bajo (Figura 3).
Las dosis de 30 mCi se aplicaron a pacientes con RR bajo en los últimos dos quinquenios, en concordancia con las recomendaciones actuales. En los casos donde se administraron dosis mayores a 30 mCi, la decisión fue determinada por el volumen del remanente tiroideo. Las dosis superiores a 150 mCi fueron utilizadas como tratamiento adyuvante en pacientes con RR alto (p < 0,001). Finalmente, como ya se mencionó, en el último quinquenio, tras una evaluación posoperatoria detallada, el 15 % de los pacientes no requirió ablación con 131I, en línea con las recomendaciones internacionales39.
El tratamiento con 131I se administró en más de una oportunidad a 11 pacientes con persistencia o recurrencia del CDT, sin que las dosis acumuladas superaran los 600 mCi.
En dos pacientes con persistencia locorregional de la enfermedad, también se requirió el uso de radioterapia externa.
La clasificación de los pacientes según su riesgo de recurrencia (RR) y mortalidad pretende ser un reflejo indirecto de la biología tumoral para guiar el tratamiento individualizado7. Los resultados en terminus de recurrencia y mortalidad proporcionan una medida de su utilidad. En nuestra serie, la tasa global de recurrencia/persistencia de la enfermedad fue del 11%, y los factores asociados a esta (multifocalidad y metástasis ganglionar del compartimento lateral) (Tabla 3) fueron similares a los descritos en otras series40,41,5.
La tasa de recurrencia global fue del 7 %, sin presentarse casos en el grupo de RR bajo (que incluye a más de la mitad de los pacientes). Esta buena correlación evidencia la aplicabilidad de los criterios de clasificación propuestos por las guías6, con una relación significativa entre la recurrencia y el riesgo inicial calculado: 0 % en el grupo de RR bajo, 16 % en el grupo de RR intermedio y 30 % en el de RR alto (p < 0,001).
La supervivencia de los pacientes con CDT en nuestra cohorte es similar a la reportada en datos nacionales e internacionales3,4,42,43. Los dos pacientes que fallecieron por CDT presentaban afectación extratiroidea extensa y metástasis a distancia, con una supervivencia del 98 % para los pacientes con enfermedad localizada y del 64 % para aquellos con metástasis a distancia (Figura 4A), con una mediana de seguimiento de 7 años. La baja mortalidad atribuida al CDT es consistente con los datos epidemiológicos de Uruguay actualizados al 2019, que indican una tasa de mortalidad de 0,33 por 100.000 habitantes4.
En cuanto a la situación final de nuestros pacientes, el estatus de ausencia de enfermedad o respuesta excelente mostró una correlación con el RR inicial calculado (p = 0,002). Se observó remisión clínica, bioquímica y estructural en el 81 % de los pacientes con RR bajo, en el 61 % de los de RR intermedio y en el 38 % de los pacientes con RR alto (una cifra ligeramente superior a la esperada según la ATA). Es posible que el seguimiento prolongado de los pacientes y el análisis de los resultados tras el tratamiento de las recurrencias hayan contribuido a mejorar los resultados finales en esta categoría.
La respuesta parcial bioquímica estructural también mostró una relación significativa con el RR calculado (p = 0,001), en concordancia con lo reflejado en otras series (Figura 4B). Como se esperaba, la respuesta indeterminada no presentó una asociación con el RR inicial. Estos resultados confirman que la herramienta de estratificación del riesgo dinámico fue útil para analizar los resultados y la respuesta al tratamiento en nuestra cohorte.
La recolección de datos retrospectivos obtenidos por diferentes investigadores en distintos centros de salud podría representar una limitación en nuestro estudio. Sin embargo, como se ha mencionado, nuestra cohorte mostró un bajo sesgo de selección, reflejando un comportamiento del CDT similar al de series más grandes, con diagnósticos en estadios tempranos de la enfermedad y un predominio de RR bajo. Además, se observó una adaptación progresiva de la conducta terapéutica a las actualizaciones de las guías clínicas. Por ello, consideramos que este estudio puede aportar información valiosa para futuras investigaciones prospectivas en nuestro medio que incluyan un mayor número de pacientes.
Conclusión
Las características clínicas de los pacientes con cáncer diferenciado de tiroides (CDT) atendidos en policlínicas de endocrinología de cinco prestadores de salud del interior de Uruguay son similares a las reportadas en centros de alto volumen. La enfermedad presenta un excelente pronóstico, y su tratamiento se ha ido ajustando progresivamente a las recomendaciones actualizadas según el riesgo de recurrencia.















