Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.1 Montevideo mar. 2004
Producción de radicales hidroxilo en sangre en pacientes ancianos hipertensos
Dres. Federico Dajas*, Alejandra Ferrari†, Aníbal Martínez‡,
Miriam Zeppi†, Br. Margot Ferreira§, Dr. Álvaro Pintos¶
Departamento de Neuroquímica, Instituto de Investigaciones Biológicas Clemente Estable y Clínica Geriátrica, Hospital de Clínicas, Facultad de Medicina. Montevideo, Uruguay.
Resumen
En el complejo y multicausal proceso que lleva a la hipertensión esencial, los radicales libres parecen jugar un papel clave, particularmente en la regulación local del lecho capilar. Además de la producción de ion superóxido en la célula endotelial, existen otros factores de producción de radicales libres, especialmente el radical hidroxilo, aun cuando la hipertensión esté medicada y clínicamente controlada.
Dado que si bien se han estudiado las defensas antioxidantes no se ha abordado todavía la generación de radicales libres en sangre en pacientes hipertensos, en el presente trabajo se estudió la producción del radical hidroxilo en sangre total en pacientes hipertensos controlados, mayores de 65 años, sin otra enfermedad y se compararon los niveles obtenidos con individuos de las mismas características, algunos de ellos hipertensos, que participaban en un programa de ejercicio y controlaban su dieta desde el punto de vista calórico. La producción del radical hidroxilo se determinó por la hidroxilación del salicilato, determinando la concentración del derivado 2,3 di-hidroxibenzoico (2,3-DHBA) por técnicas de cromatografía líquida de alta performance con detección electroquímica.
Las concentraciones de 2,3-DHBA luego de la interacción de la sangre con la molécula de salicilato en tubo fueron significativamente mayores en los pacientes hipertensos que en los individuos controles. En los individuos hipertensos que realizaban ejercicios se observó una tendencia a una menor producción de radicales hidroxilo.
De acuerdo con estos datos, la hipertensión esencial, aun medicada, se acompañaría de una producción elevada de radicales hidroxilo por los elementos formes de la sangre, que el ejercicio y la dieta tienden a disminuir. Aunque no podemos hablar de estrés oxidativo ya que no se determinó el estado de las defensas antioxidantes, es probable que estos radicales, si no son neutralizados, contribuyan a la enfermedad vascular que se observa en la hipertensión esencial. Estos resultados se ubicarían en la línea de investigación que propende a un control activo de la producción radicalaria aumentada en la hipertensión, además de la medicación antihipertensiva.
Palabras clave: HIPERTENSIÓN.
RADICAL HIDROXILO.
ANCIANO.
* Médico psiquiatra, jefe del Departamento de Neuroquímica.
† Médico posgrado de Clínica Geriátrica.
‡ Médico becario del Departamento de Neuroquímica.
§ Becaria del Departamento de Neuroquímica.
¶ Prof. Director de Clínica Geriátrica.
Correspondencia: Dr. Federico Dajas
Departamento de Neuroquímica, Instituto de Investigaciones
Biológicas Clemente Estable.
Avda. Italia 3318, 11600. Montevideo, Uruguay.
E-mail: fdajas@iibce.edu.uy
Recibido: 4/8/03.
Aceptado: 6/2/04.
Introducción
Una intensa investigación ha vinculado el estrés oxidativo a la patología de las enfermedades de mayor prevalencia en la edad avanzada como arteriosclerosis, diabetes, afecciones neurodegenerativas, artrosis, etcétera(1-6). La energía que nos mantiene vivos y activos proviene de una ordenada transferencia de electrones del oxígeno molecular en la maquinaria metabólica de la mitocondria, que culmina en la formación de agua, anhídrido carbónico y energía. Esta transferencia puede generar formas intermedias del oxígeno con un electrón desapareado que son algunos de los llamados radicales libres. El estrés oxidativo se refiere a un predominio de especies reactivas del oxígeno (ROS) sobre las defensas naturales, enzimáticas y no enzimáticas. Como tal, es el resultado de un desequilibrio que implica importantes consecuencias ya que las ROS reaccionan con estructuras y componentes celulares (membranas, proteínas, genes) provocando daño y eventualmente muerte celular.
Las ROS, sin embargo, se pueden producir durante el funcionamiento fisiológico celular. El superóxido se genera por acción de varias oxidasas y de su destino depende en gran parte el equilibrio oxidativo celular. Puede ser dismutado por la superóxido dismutasa a peróxido para dar luego una molécula de agua o bien reaccionar con el NO (óxido nítrico) para dar el peroxinitrito, potente oxidante celular capaz de provocar daño celular. En presencia de hierro se genera el radical hidroxilo que reacciona con membranas, proteínas y genes, comenzando procesos como la lipoperoxidación de membranas, que altera los equilibrios iónicos, colocando a la célula en una situación de dese-quilibrio oxidativo que, de no ser contrabalanceada por defensas antioxidantes, lleva a la muerte celular.
El automantenimiento de los procesos patológicos que genera el estrés oxidativo es la característica más ominosa desde el punto de vista de la homeostasis general del organismo, generando círculos viciosos de ROS -daño celular-más ROS-más daño-. Identificar tempranamente la existencia de estrés oxidativo y tomar medidas terapéuticas para su control, aparece cada vez más como una medida necesaria para estabilizar las enfermedades de base como la hipertensión, la diabetes, etcétera(5,6).
El endotelio es un regulador activo de la tensión vascular. Por ello, aparte de las causas más generales, existen en la hipertensión importantes procesos endoteliales vinculados a la enfermedad. En situación normal el endotelio recibe señales provenientes de angiotensina, prostaglandinas, endotelinas, factor hiperpolarizante derivado del endotelio (FHDE) y óxido nítrico(7,8).
Normalmente, enzimas endoteliales claves como la xantino-oxidasa (XO), la óxido nitrico sintetasa y, por otro lado, NADPH generan radicales superóxido. Por razones aún desconocidas en el caso de la XO y de NADPH, éstos pasan a generar mayor cantidad de radical superóxido en la hipertensión(7).
En el caso de la óxido nítrico sintetasa, el flujo de electrones ocurre desde el dominio oxigenasa al reductasa y depende de equilibrios termodinámicos y conformacionales. Este delicado equilibrio puede romperse y la enzima quedar "desacoplada", tendiendo a producir superóxido a partir de NADPH , sin llegar a la producción de NO(8).
En la hipertensión se produce una activación concomitante de los elementos formes de la sangre, particularmente leucocitos, los que tienden a aumentar su interacción con la pared endotelial, generando más radicales libres(7,8). En la hipertensión arterial, por lo tanto, se genera un escenario endotelial-vascular altamente oxidativo, desviado hacia la generación de radicales libres que tienden a empeorar la hipertensión, creándose un círculo vicioso de agravamiento(7-11).
A escala experimental la generación aumentada de ion superóxido ha sido demostrada en todas las formas de hipertensión: espontánea, generada por angiotensina, corticoides, etcétera(7). A nivel clínico se ha descrito una disminución en los niveles de atrapadores de radicales como tocoferol, una actividad disminuida de la enzima superóxido dismutasa o una actividad aumentada de la enzima glutatión peroxidasa(12-15).
Una evaluación de la lipoperoxidación ha mostrado una producción incrementada de malondialdehido y existen evidencias clínicas de la participación de los leucocitos en el estrés oxidativo(16-23). Por otra parte, como el estrés oxidativo ha sido vinculado al envejecimiento, es probable que exista un agravamiento de éste cuando la hipertensión se asocia a la edad(24-27).
La mayor parte de los estudios del estrés oxidativo en clínica se refieren al consumo de las defensas enzimáticas y no enzimáticas y a las consecuencias del estrés como la lipoperoxidación. Pocos trabajos determinan directamente las ROS, especialmente el OH?, principalmente por su extremadamente corta vida media.
Sin embargo, mientras que las defensas antioxidantes pueden estar elevadas o disminuidas en presencia de estrés oxidativo -correspondiendo a las fases de control y descontrol de éste- la determinación directa de los radicales puede dar una idea del nivel oxidativo instantáneo del organismo. Una evaluación precisa del estrés oxidativo requiere la determinación concomitante de las defensas antioxidantes y ROS.
La determinación de OH? se realiza por la generación de derivados estables que puedan ser evaluados en forma práctica. La hidroxilación del salicilato, una alternativa planteada hace varios años por Halliwell y colaboradores se ha transformado en la más popular dada su accesibilidad por técnicas de cromatografía líquida de alta performance(28-38).
Luego de una ingesta oral de ácido acetilsalicílico, este es hidroxilado por los OH? que encuentra en los tejidos del organismo, generándose el derivado 2,3 di dihidroxibenzoico (2,3-DHBA) (figura 1). El 2,3-DHBA es estable y circula en sangre, pudiendo ser detectado y medido en plasma. De esta forma se obtiene una idea de la producción de OH? en todo el organismo.
Ya que los elementos formes de la sangre son importantes generadores de ROS, en nuestro grupo desarrollamos una técnica para medir la producción de OH? en sangre. Una muestra de sangre fresca se mezcla con salicilato en un tubo y se agita. Los OH? producidos son captados instantáneamente por hidroxilación del salicilato dando 2,3-DHBA, el que puede ser determinado por cromatografía líquida de alta presión a posteriori(28-36).
De los elementos formes de la sangre, los eritrocitos y leucocitos son importantes generadores de peróxido de hidrógeno y superóxido. En la edad avanzada, a la posible presencia de factores que generan un escenario oxidativo, activador de los leucocitos, se agrega la limitada elasticidad de la pared vascular que obliga a una mayor distorsión de las membranas celulares y su mayor exposición, con eventual aumento de la lipoperoxidación en la membrana eritrocitaria. Con la edad se generaría una situación potencialmente oxidativa que empeoraría las enfermedades de base en un círculo vicioso que debería ser necesario interrumpir desde un punto de vista preventivo.
Sin embargo, en clínica aún no se ha determinado la generación de radical hidroxilo en sangre en la hipertensión esencial. A los efectos de contribuir al estudio de esta situación, determinamos la producción de radicales hidroxilo en pacientes hipertensos, luego de hacer interaccionar salicilato con sangre total, a los efectos de observar la producción sistémica de radical hidroxilo y su producción instantánea en sangre. Por lo que hemos podido evaluar de la bibliografía, sería la primera vez que se realiza este análisis.
Material y método
Pacientes y controles
Los participantes en este estudio tenían más de 65 años de edad. Fueron seleccionados en la Clínica de Geriatría del Hospital de Clínicas por dos geriatras con experiencia, entre aquellos que atendían regularmente los servicios de policlínica. Todos los participantes sufrían de hipertensión, medicada y controlada. No presentaban otra enfermedad como diabetes o artritis. También se excluyeron cardiopatías, nefropatías u otras enfermedades crónicas.
Los controles se reclutaron en los grupos de tercera edad de la Asociación de Empleados Bancarios del Uruguay (AEBU) y de la Asociación Cristiana de Jóvenes. Mayores de 65 años, de ambos sexos, participaban de un programa de ejercicios tres veces por semana (60 minutos cada vez) y en su mayoría seguían una dieta rica en frutas y verduras. Como tal se consideró la presencia de vegetales en la dieta más de tres veces por semana y la presencia de proteínas de pollo y pescado por lo menos más de una vez en la semana, en forma regular y por un período mayor de un año. Constituido el grupo, se separaron aquellos que no presentaban ninguna enfermedad y los que tenían un diagnóstico de hipertensión esencial, sin afecciones concomitantes.
Procedimientos y métodos
El grupo de individuos estudiados estuvo constituido por un grupo de pacientes hipertensos sedentarios (n=28) o que realizaban ejercicio (n=12), así como un grupo de controles (n=8). Todos los participantes tenían por lo menos cuatro horas de ayuno (incluso para té y café) al momento de la extracción de sangre, que se realizó hacia las 10:00 horas de la mañana. Todos fueron entrevistados por lo menos por un médico geriatra que realizó una cuidadosa historia clínica, interrogando particularmente sobre enfermedades concomitantes en el caso de la hipertensión y sobre hábitos alimenticios y de actividad física.
Estas entrevistas se realizaron en la Policlínica de Geriatría del Hospital de Clínicas o en los departamentos médicos de AEBU y la Asociación Cristiana de Jóvenes.
Luego de la entrevista clínica se les extrajo 10 ml de sangre del pliegue antecubital con una jeringa previamente lavada con heparina (Liquemine Roche), la que se distribuyó en dos tubos. Uno era un tubo seco y el otro tenía 100 ?l de una solución de salicilato de sodio 1M. En este caso se agitó la mezcla sangre-salicilato lentamente por espacio de un minuto. El primer tubo daba el valor basal de 2,3-DHBA que se restaba del valor obtenido en el segundo.
Los tubos se mantuvieron a 4ºC, en hielo, forma en que fueron transportados al laboratorio donde se centrifugaban para obtención de plasma y se guardaban a -70ºC hasta su análisis.
Análisis de 2,3-DHBA
Muestras de plasma se colocaban en tubos Ependorff de 1 ml a los que se agregaba ácido perclórico 1M y se agitaban vigorosamente (vortex). La solución resultante se centrifugaba por 15 minutos a 15000 por g a 4ºC y el sobrenadante se utilizaba para análisis de cromatografía líquida de alta presión (HPLC). Todas las muestras se procesaron en duplicado.
El 2,3-DHBA se midió por cromatografía líquida de alta presión con detección electroquímica (HPLC.LC). El equipo de HPLC utilizado fue un BAS LC-4B (Bioanalytical Systems, West Lafayette, IN, USA) equipado con una columna cromatográfica C18 Waters (3,9 por 150 mm). La máxima sensibilidad amperométrica utilizada fue 1 nA y el potencial de oxidación se fijó a 0.6 V. Se utilizó un electrodo de carbón vítreo contra un electrodo de referencia Ag/AgCI. Otros parámetros cromatográficos se utilizaron de acuerdo con Floyd y colaboradores(31).
Reactivos
Los solventes para HPLC fueron comprados a Baker (Phillipsburg, PA, USA) y eran de grado analítico. El salicilato se obtuvo de Analar y el 2,3 y 2,5 DHBA que se utilizaron como estándares se importaron de Sigma Chemicals (St. Louis, USA).
Ética
La metodología utilizada y el diseño general de este estudio fueron aprobados por el Comité de Ética del Hospital de Clínicas, que monitoreó el desarrollo del mismo. Todos los pacientes firmaron un consentimiento informado.
Análisis estadístico
Las diferencias entre medias en pacientes fueron analizadas por el test de Student. La significación estadística se fijó en p<0,05. Los datos se muestran como la media ± SEM (error estándar).
Resultados
Aunque la hidroxilación del salicilato puede generar dos derivados: el 2,3 y el 2,5-DHBA, que se diferencian por la posición de la hidroxilación, de hecho sólo la hidroxilación en posición 3 corresponde a una acción de "atrapamiento" del radical. La hidroxilación en posición 5 es fruto de un proceso enzimático. Existe amplio acuerdo entre los investigadores en este aspecto(33,39) y en nuestro caso los niveles encontrados de 2,5-DHBA en tubo eran muy bajos. Por ello, en el presente trabajo sólo se tomó en cuenta la producción de 2,3-DHBA como indicación de producción del radical hidroxilo por la sangre.
Algunos parámetros vitales medios de los pacientes fueron: presión arterial media: 150/80 mmHg ± 15/10; edad: 73,3 ± 6,1 años; peso: 69,6 ± 12,4 kg; altura: 1,57 ± 0,90 m; frecuencia cardíaca: 75 ± 8 cpm. Los controles no difirieron significativamente en ninguno de esos valores, excepto la presión arterial.
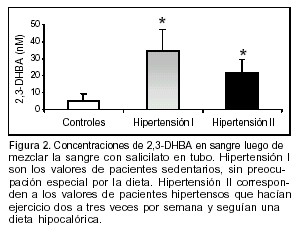
Las concentraciones de 2,3-DHBA obtenidas luego de la reacción de salicilato con sangre total en tubo fueron significativamente más elevadas en pacientes hipertensos que en controles. Los pacientes hipertensos que realizaban ejercicio y se preocupaban por la dieta mostraron una menor concentración de 2,3-DHBA, aun significativamente más elevada que los controles (figura 2).
Discusión
La determinación directa de las especies radicalarias del oxígeno no es común en clínica; la situación oxidativa del organismo es comúnmente evaluada por el estado de las defensas antioxidantes y por las consecuencias de las acciones de los radicales libres (liperoxidación, daño al DNA, etcétera). Sin embargo, la estimación de radicales libres como el ion hidroxilo puede dar una medida de la situación óxido-reductiva celular en un momento dado y en conjunto con una evaluación de las defensas (por ejemplo: superóxido dismutasa, catalasa, tocoferol, etcétera) proporciona una visión más acabada de la presencia -y de la dimensión- del estrés oxidativo.
La determinación del radical hidroxilo ofrece dificultades particulares y requiere métodos sofisticados. Hace unos años Halliwell y colaboradores(29,30) propusieron la capacidad del OH? de hidroxilar la molécula de salicilato como una medida de su producción(30). El OH? hidroxila el salicilato para dar el derivado 2,3 DHBA que puede ser detectado por HPLC con detección electroquímica. Desde su descripción, el método se ha popularizado a escala experimental y clínica(33-36,38-43).
En la forma en que el método es utilizado por nosotros se detectaron concentraciones de 2,3-DHBA en pacientes que nunca habían tomado AAS en forma similar a otros estudios previos(2,42). El ácido salicílico es un componente habitual de la dieta, encontrándose en las plantas (verduras, mate, etcétera) donde es un metabolito importante, comportándose como una señal de estrés(44,45). Es dable pensar que una vez en el organismo este salicilato reaccione con los radicales OH? que se producen en los tejidos, formándose el 2,3-DHBA. En el presente estudio este valor basal, cuando se detectó, se restó del obtenido luego de la reacción de salicilato y sangre en tubo, para que el valor obtenido en este último caso fuera expresión más acabada de la producción instantánea de OH?.
Nuestros resultados muestran una mayor producción de radicales OH? en pacientes hipertensos que en controles de la misma edad. Esto no quiere decir que exista estrés oxidativo ya que para afirmar la existencia de estrés necesitaríamos medir concomitantemente el estado de las defensas antioxidantes. Un nivel elevado de defensas podría estar dando cuenta de una producción elevada de radicales. Podemos sí afirmar que existe una mayor producción de OH? en sangre de pacientes hipertensos, lo cual es un riesgo potencial. Es importante la comprobación de la tendencia que el ejercicio y la dieta muestran hacia la disminución de la generación de OH•.
Existen evidencias de que en la hipertensión esencial se produce un aumento de lipoperoxidación en los glóbulos rojos y una activación de los leucocitos(20,21). Dado que el salicilato puede atravesar membranas, con nuestra técnica estaríamos observando la capacidad instantánea de estos elementos formes activados de generar radicales OH?. Existiría una generación elevada de radicales libres en sangre, la que se sumaría a su producción aumentada en la célula endotelial , lo que agravaría el proceso de base al consumir aún más defensas y, directamente, agentes vasodilatadores como el NO.
Se ha reportado recientemente una disminución de la presión arterial por tratamiento de pacientes hipertensos con ácido ascórbico, dado como antioxidante(7,9,10). Sin embargo, la falta de consecuencias prácticas de tratamientos con vitamina E en grandes poblaciones ha sido un argumento importante en contra del efecto beneficioso de antioxidantes en la hipertensión esencial. Debe recordarse, empero, que la vitamina E es un antioxidante liposoluble y, por lo tanto, fundamental al nivel de membranas celulares, sobre todo en relación con la lipoperoxidación. La acción antioxidante de la vitamina E lleva a la producción del radical tocoferilo y es necesario una cadena antioxidante que se integra también con la vitamina C (ácido ascórbico) para que el tocoferol no termine a su vez formando parte de la cadena lipoperoxidante.
La ancianidad es una condición que favorece la aparición de estrés oxidativo(3,5,24) y ello puede estar contribuyendo a facilitar de alguna manera la generación de OH?. Un estudio en pacientes hipertensos jóvenes, en hipertensión de comienzo temprano -que estamos realizando en el momento actual- aparece como imprescindible para establecer los alcances de los resultados obtenidos en pacientes ancianos.
La contribución más importante de este estudio radica en la descripción y aplicación por primera vez de un test simple que permite tener una idea de la situación oxidativa instantánea del organismo en enfermedades de alta prevalencia como la hipertensión. Complementado por otros indicadores de estado oxidativo, como la capacidad antioxidante del plasma, puede darnos una idea acabada de las acciones preventivas a realizar y una medida de su efectividad. Más allá de aplicar o no terapias antioxidantes específicas -otro de los objetivos de investigación abiertos por los resultados obtenidos- estas medidas pueden dar una idea cuantitativa del esfuerzo antioxidante a realizar con medidas higiénicas que abarquen la dieta, el ejercicio, etcétera.
Agradecimientos
Los autores agradecen la colaboración de Nilda Acuña y de la Dra. Fernanda Blasina con la obtención de muestras. Agradecen asimismo a las autoridades de la Asociación Cristiana de Jóvenes y especialmente a su departamento médico (Dr. C. Bermúdez) por la colaboración prestada para poder realizar los estudios en controles. Lo mismo agradecen a las autoridades del complejo deportivo de AEBU.
Los autores desean agradecer especialmente a los pacientes y a aquellos que participaron como controles, que en forma desinteresada y entusiasta colaboraron con la presente investigación.
Summary
Free radicals seem to play an important role in the complex and multicausal process that leads to essential hypertension, particularly in the local regulation of capillary bed. Apart from the superoxide ion production in endothelial cells there are other factors that produce free radicals, specially hydroxyl radical, even when hypertension is treated with drugs and clinically controlled. Hydroxil radical production was study in patients with controlled hypertension and no other pathology, older than 65 years.
Results were compared to a group of people with similar characteristics, some with hypertension, who were in an exercise and caloric-controlled program. Hydroxil radical production was determined by salicylate hydroxylation; derivative 2,3-dihydroxybenzoic (2,3-DHBA) by Liquid Chromatography of High Performance with Electrochemical Detection techniques.
Levels of 2,3-DHBA after the interaction between plasma and salicylate molecules were significantly higher in patients with hypertension compared to control group. Patients with hypertension and under the exercise program showed a trend to decrease hydroxyl radical production. According to these facts, essential hypertension, even under treatment, is accompanied by a higher hydroxyl radical production that exercise and diet tend to diminish.
Although we are not able to talk in terms of oxidative stress since antioxidant banners were not determined, hydroxyl radicals, if not neutralized, are involved in the vascular pathology observed in essential hypertension. The results support the idea to control radical production, increased in hypertension, as well as prescribing antihypertensive pharmacological treatment.
Résumé
Dans le complexe processus qui mène à l'hypertension essentielle, les radicaux libres semblent jouer un rôle important, surtout en ce qui concerne la régulation locale du lit capillaire. A part la production d'ion superoxyde dans la cellule endothéliale, il existe d'autres facteurs de production de radicaux libres, particulièrement le radical hydroxyle, même si la tension est cliniquement contrôlée. Bien qu'on ait déjà étudié les défenses antioxydantes, on n'a pas encore abordé la génération de radicaux libres en sang chez des patients hypertendus. Dans ce travail, on analyse la production du radical hydroxyle en sang total chez des patients hypertendus contrôlés, âgés de plus de 65 ans, sans autre pathologie et on a comparé les niveaux obtenus avec des individus de mêmes caractéristques, quelques-uns hypertendus, qui participaient à un programme d'exercice et qui contrôlaient leur alimentation du point de vue calorique. La production du radical hydroxyle a été déterminé par l'hydroxylation du salicylate, tout en déterminant la concentration du dérivé 2,3 di-hydroxybenzoique (2,3-DHBA) par des techniques de Chromatographie Liquide de haute Performance avec Détection Électrochimique.
Les concentartions de 2,3-DHBA après interaction du sang avec la mollécule de salicylate ont été remarquable-ment plus élevées chez les patients hypertendus que chez les individus contròles. Chez les individus hypertendus qui faisaient des exercices on a observé une tendance à une production moins grande de radicaux hydroxyle. Selon ces données, l'hypertension essentielle, même traitée avec des médicaments, serait accompagnée d'une production élevée de radicaux hydroxyle par les éléments formes du sang, que l'exercice physique et la diète peuvent diminuer. Quoiqu'on ne puisse pas parler de stress oxydatif, car on n'a pas déterminé l'état des défenses antioxydantes, il est probable que ces radicaux, s'ils ne sont pas neutralisés, contribuent à la pathologie vasculaire qu'on observe à l'hypertension essentielle. Ces résultats se situeraient dans la ligne de recherche qui mène à un contrôle actif de la production radicalaire augmentée à l'hypertension, en plus des médicaments hypotenseurs.
Bibliografía
1. Ghiselli A, Laurenti O, De Mattia G, Maiani G, Ferro-Luzzi A. Salicylate hydroxylation as an early marker of in vivo oxidative stress in diabetic patients. Free Radic Biol Med 1992; 13(6): 621-6.
2. Martignoni E, Blandini F, Godi L, Pacchetti C, Mancini F, Nappi G. Peripheral markers of oxidative stress in Parkinson's disease. The role of L-DOPA. Free Radic Biol Med 1999; 27(3-4): 428-37.
3. Sinclair AJ, Bayer AJ, Johnston J, Warner C, Maxwell SR. Altered plasma antioxidant status in subjects with Alzheimer's disease and vascular dementia. Int J Geriatr Psychiatry 1998; 13(12): 840-5.
4. Tubaro M, Cavallo G, Pensa V, Chessa MA, Natale E, Ricci R, et al. Demostration of the formation of hydroxyl radicals in acute myocardial infarction in man using salicylate as probe. Cardiology 1992; 80(3-4): 246-51.
5. Halliwell B. Reactive Oxygen Species and the Central Nervous System. J Neurochem 1992; 59(5) :1609-23.
6. Floyd RA. Role of oxygen free radical in carcinogenesis and brain ischemia. FASEB J 1990; 4(9): 2587-97.
7. Zalba G, San José G, Moreno MU, Fortuño MA, Fortuño A, Beaumont FJ, et al. Oxidative stress in arterial hypertension. Role of NAD(P)H oxidase. Hypertension 2001; 38(6): 1395-9.
8. Kharbanda RK, Deanfield JE. Functions of the healthy endothelium. Coron Artery Dis 2001;12(6): 485-91
9. Landemmer U, Harrison DG. Oxidative stres and vascular damage in hypertension. Coron Artery Dis 2001; 12(6): 455-61.
10. Landmesse U, Harrison DG. Oxidant stress as a marker for cardiovascular events: Ox marks the spot. Circulation 2001; 104(22): 2638-40
11. Napoli C, Lerman L. Involvement of oxidation sensitive mechanisms in the cardiovascular effects of hypercholesterolemia. Mayo Clin Proc 2001; 76(6): 619-31.
12. Russo C, Olivieri O, Girelli D, Faccini G, Zenari ML, Lombardi S, et al. Anti-oxidant status and lipid peroxidation in patients with essential hypertension. J Hypertens 1998; 16(9): 1267-71.
13. Nakazono K, Watanabe N, Matasuno K, Sasaki J, Sato T, Inoue M. Does superoxide underlie the patogenesis of hypertension? Proc Natl Acad Sci 1991; 88(22): 10045-8.
14. Schneider R, Iscovitz H, Ilan Z, Bernstein K, Gros M, Iaina A. Oxygen free radical scavenger system intermediates in essential hypertensive patients before and immediately after sublingual captopril administration. Isr J Me. Sci 1990; 26(9): 491-5.
15. Parik T, Allikmets K, Tessalu R, Zilmer M. Oxidative stress and hyperinsulinaemia in essential hypertension: different facets of increased risk. J Hypertens 1996; 14(3): 407-10.
16. Kabi BC, Goel N, Rao YN, Tripathy R, Tempe A, Thakur, AS. Levels of erythrocyte malonyldialdehyde, vitamin E, reduced glutathione, G&PD activity and plasma urate in patients of pregnancy induced hypertension. Indian J Med Res 1994; 100: 23-5.
17. Swei A, Lacy F, Delano FA, Schmid-Schönbein GW. Oxidative stress in the Dahl hypertensive rat. Hypertension 1997; 30(6): 1628-33.
18. Vaziri ND, Wang XQ, Oveisi F, Rad B. Induction of oxidative stress by glutathione depletion causes severe hypertension in normal rats. Hypertension 2000; 36(1): 142-6.
19. Romero-Alvira D, Roche E. High blood pressure, oxygen radicals and antioxidants: etiological relationships. Med Hypotheses 1996; 46(4): 414-20.
20. Alexander RW, Cooper T. Memorial Lecture. Hypertension and the pathogenesis of atherosclerosis. Oxidative stress and the mediation of arterial inflammatory response: a new perspective. Hypertension 1995; 25(2): 155-61.
21. Kristal B, Shurtz-Swirski R, Chezar J, Manaster J, Levy R, Shapiro G, et al. Participation of peripheral polymorphonuclear leukocytes in the oxidative stress and inflammation in patients with essential hypertension. Am J Hypertens 1998; 11(8 Pt 1): 921-8.
22. Zalba G, Beaumont J, San José G, Fortuño A, Fortuño MA, Diez J. Vascular oxidant stress: molecular mechanisms and pathophysiological implications. J Physiol Biochem 2000; 56(1): 57-64.
23. Fukai T, Siegfried MR, Ushio-Fukai M, Griendling KK, Harrison DG. Modulation of extracellular superoxide dismutase expression by angiotensin II and hypertension. Circ Res 1999; 85(1): 23-8.
24. Paolisso G, Tagliamonte MR, Rizzo MR, Manzella D, Gambardella A, Varricchio M. Oxidative stress and advancing age: results in healthy centenarians. J Am Geriatr Soc 1998; 46(7): 833-8.
25. De Angelis KL, Oliveira AR, Werner A, Bock P, Bello-Klein A, Fernández G, et al. Exercise training in aging: hemodynamic, metabolic, and oxidative stress evaluations. Hypertension 1997; 30(e Pt 2): 767-71.
26. Ji LL, Leeuwenburgh C, Leichtweis S, Gore M, Fiebig R, Hollander J, et al. Oxidative stress and aging. Role of exercise and its influences on antioxidant systems. Ann N Y Acad Sci 1998; 854: 102-17.
27. Rubanyi GM. Vascular effects of oxygen-derived free radicals. Free Rad Biol Med 1988; 4(2): 107-20.
28. Halliwell B, Kaur H. Aromatic hydroxylation of phenylalanine as an assay for hydroxyl radicals. Measurement of hydroxyl radical formation from ozone and in blood from premature babies using improved HPLC methodology. Anal Biochem 1994; 220(1): 11-5.
29. Halliwell B, Kaur H. Hydroxylation of salicylate and phenylalanine as assays for hydroxyl radicals: a Cautionary note visited for the third time. Free Rad Res 1997; 27(3): 239-44.
30. Floyd RA, Watson J, Wong PK. Sensitive assay of hydroxyl free radical formation utilizing high pressure liquid chromatography with electrochemical detection of phenol and salicylate hydroxylation products. J Biochem Biophys Methods 1984; 10(3-4): 221-35.
31. Floyd RA, Henderson R, Watson J, Wong PK. Use of salicylate with high pressure liquid chromatography and electrochemical detection (LCED) as a sensitive measure of hydroxyl free radical in Adriamycin treated rats. J Free Rad Biol Med 1986; 2(1): 13-8.
32. Halliwell B, Kaur H, Ingelman-Sundberg M. Hydroxylation of salicylate as an assay for hydroxyl radicals: a cautionary note. Free Rad Biol Med 1991; 10(6): 439-41.
33. Coudray C, Talla M, Martin S, Fatôme M, Favier A. High-performance liquid chromatography-electrochemical determination of salicylate hydroxylation products as an in vivo marker of oxidative stress. Anal Biochem 1995; 227(1): 101-11.
34. Grootveld M, Halliwell B. Aromatic hydroxylation as a potential measure of hydroxyl radical formation in vivo. Identification of hydroxylated derivatives of salicylate in human body fluids. Biochem J 1986; 237(2):499-504.
35. Tsai TH, Cheng FC, Hung LC, Chen CF. Measurement of hydroxyl radical in rat blood vessel by microbore liquid chromatography and electrochemical detection: an on-line microdialysis study. J Chromatogr B Biomed Sci Appl 1999; 734(2): 277-83.
36. Powell SR. Commentary. Salicylate trapping of OH as a tool for studying post-ischemic oxidative injury in the isolated rat heart. Free Rad Res 1994; 21(6): 355- 70.
37. Thome J, Zhang J, Davids E, Foley P, Weijers H-G, Wiesbeck GA, et al. Evidence for increased oxidative stress in alcohol-dependent patients provided by quantification of in vivo salicylate hydroxylation products. Alcohol Clin Exp Res 1997; 21(1): 82-5.
38. Kaur J, Edmonds SE, Blake DR, Halliwell B. Hydroxyl radical generation by reumatoid blood and knee joint synovial fluid. Ann Rheum Dis 1996; 55(12): 915-20.
39. Grootveld M, Halliwell B. 2,3-Dihydroxybenzoic acid is a product of human aspirin metabolism. Biochem Pharmacol 1988; 37(2): 271-80.
40. Liu L, Leech JA, Urch RB, Silverman FS. In vivo salicylate hydroxylation: a potent biomarker for assesing acute ozone exposure and effects in humans. Am J Respir Crit Care Med 1997; 156(5): 1405-12.
41. Paterson JR, Blacklock C, Campbell G, Wils D, Lawrence JR. The identification of salicylate as normal constituent of serum: a link between diet and health? J Clin Pathol 1998; 51(7): 502-5.
42. Palumbo G, Carlucci G, Mazzeo P, Frieri G, Pimpo MT, Fanini D. Simultaneous determination of 5- aminosalicylic acid, acetyl-5-aminosalicylic acid and 2,5-dihydroxybenzoic acid in endoscopic intestinal biopsy samples in humans by high-performance liquid chromatography with electrochemical detection. J Pharm Biomed Anal 1995; 14(1-2): 175-80.
43. Narayan M, Berliner LJ, Merola AJ, Díaz PT, Clanton TL. Biological reactions of peroxinitrite: evidence for an alternative pathway of salicylate hydroxylation. Free Radic Res 1997; 27(1): 63-72.
44. Vernooij B, Uknes S, Ward E, Ryals J. Salicylic acid as a signal molecule in plant-pathogen interactions. Curr Opin Cell Biol 1994; 6(2): 275-9.
45. Yalpani N, Raskin I. Salicylic acid: a systemic signal induced plant disease resistance. Trends Microbiol 1993; 1(3): 88-92.