Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.1 Montevideo mar. 2004
Consideraciones generales sobre el mercurio, el timerosal, y su uso en vacunas pediátricas
Dra. Betzana Zambrano*
Resumen
El timerosal, derivado del mercurio, ha sido utilizado en medicina por sus propiedades antisépticas. Desde hace más de 60 años ha sido usado como conservante en vacunas para evitar el sobrecrecimiento bacteriano, especialmente en frascos multidosis. Sin embargo, desde fines de la década de 1990 su uso ha sido cuestionado en Estados Unidos y Europa por el riesgo teórico de exposición en niños pequeños, con sus potenciales efectos en el desarrollo neurológico. Este cuestionamiento motivó a organizaciones internacionales, gubernamentales y no gubernamentales, entre ellas a grupos de asesores de la Organización Mundial de la Salud, desde el año 2001, a revisar la información disponible hasta la fecha. Estos grupos de expertos concluyeron que actualmente no existe evidencia del daño por exposición al mercurio en niños y adultos que reciben vacunas con timerosal y, en consecuencia, no existe razón para cambiar las actuales prácticas de inmunización con vacunas que contienen timerosal.
Palabras clave: TIMEROSAL.
MERCURIO.
VACUNAS SINTÉTICAS.
* Pediatra. Médico Responsable de Investigación y Desarrollo de Vacunas de Latinoamérica para Aventis Pasteur y Laboratorios Clausen.
Correspondencia: Dra. Betzana Zambrano
Acevedo Díaz 1513. CP 11200 Montevideo, Uruguay.
E-mail: betzana.zambrano.avp@clausen.com.uy
Recibido: 31/3/03.
Aceptado: 10/10/03.
El autor aclara que los enunciados reflejan su opinión y no necesariamente la de Laboratorios Clausen o de Aventis Pasteur.
Introducción
Uno de los mayores logros en salud ha sido el control de enfermedades transmisibles mediante la vacunación. Para alcanzar este objetivo, el desarrollo continúa hacia la elaboración de nuevas vacunas, cada vez más eficaces y más seguras. El mayor conocimiento de antígenos, excipientes y conservantes ha provocado una mayor preocupación en el tema de seguridad. Este documento de carácter informativo representa una revisión acerca del mercurio, (sus derivados, su presencia en el medio ambiente y en la dieta, sus efectos en el hombre) y del timerosal, conservante derivado del mercurio, utilizado en algunas vacunas por más de 60 años y cuyo uso ha sido cuestionado desde fines de la década de 1990 por el mercurio, al cual podrían estar expuestos los niños, en especial los menores de 6 meses de edad, y sus potenciales efectos en el desarrollo neurológico. Se incluyen también estudios realizados en niños con vacunas conteniendo timerosal y finalmente se presenta la posición internacional con relación al uso del timerosal en vacunas, desde las primeras recomendaciones en 1999 hasta las más recientes publicadas por la Organización Mundial de la Salud (OMS) en 2002, acerca de grupos de expertos SAGE (Grupo Estratégico Consultor de Expertos) y el Comité Consultivo Mundial sobre la Seguridad en Vacunas (GACVS)) concluyendo que actualmente no existe evidencia de daño por exposición al mercurio en lactantes, niños o adultos expuestos a vacunas que contienen timerosal y, en consecuencia, que no existe una razón para cambiar las actuales prácticas de inmunización con vacunas con timerosal.
Mercurio
El mercurio (Hg por su antiguo nombre Hydrargyrum. Del griego: hydrárgyros: de hýdor, agua y árgyros, plata(1)) o azogue, es un metal que puede encontrarse en el ambiente en tres formas: a) como elemento metálico, [Hg elemental o vapor de Hg, sin cargas: Hg0, o monovalente -mercurioso- Hg+, o divalente -mercúrico- Hg2+ por oxidación]; b) como sales inorgánicas [Hg2Cl2, el cloruro mercurioso o calomel] y c) como componentes orgánicos, por ejemplo: etil-mercurio [etil-Hg], metil-mercurio [MeHg], dietil-mercurio [Hg(CH3)2], fenil-mercurio. Las sales mercúricas en su forma de vapor producen más irritabilidad y toxicidad agudas. En el siglo XVIII el nitrato de Hg era usado en las fábricas de sombreros, y los trabajadores de esas fábricas resultaban crónicamente afectados, con trastornos neurológicos por exposición al mercurio. De allí el término inglés de "mad as a hatter" ("loco como un sombrerero")(2). Los trastornos de conducta fueron descritos en el libro de Lewis Carroll Alicia en el País de las Maravillas, en su personaje de Mad Hatter(3).
Fuentes de mercurio en el medio ambiente
En el medio ambiente el Hg está presente en forma orgánica e inorgánica. En el suelo puede encontrarse a concentraciones que van de 0,05 a 0,08 µg/g. El agua fresca de algunos lagos puede contener 0,2 µg/L(5). Se le puede encontrar en termómetros, tensiómetros, pilas, amalgamas dentales, o en alimentos como el pescado. La exposición primaria en el medio ambiente se produce a través del consumo de pescados depredadores contaminados con MeHg. Las plantas industriales que queman carbón generan emisiones de Hg. El Hg elemental o sus sales inorgánicas pueden llegar al agua de lagos, ríos y mares a través de desechos industriales. Una vez depositado en el fondo lodoso de estos lugares es transformado en Hg orgánico (MeHg) por procesos biológicos en los cuales intervienen microorganismos (fitoplancton, hongos, bacterias). Este Hg orgánico es captado por insectos en el lodo, los cuales son consumidos por animales más grandes, el proceso continúa (bioacumulación), los niveles de Hg aumentan a través de la cadena alimenticia hasta llegar a peces más grandes y a partir de ellos ser consumidos por el hombre(2). Por esto, las principales fuentes de Hg orgánico en la dieta provienen de alimentos del mar (pescados tipo pez espada, atún, tiburón, róbalo y mariscos)(4,5). El mercurio orgánico en forma de MeHg puede cruzar tanto la barrera hemato-encefálica como la placentaria.
Timerosal
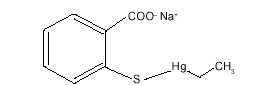
El timerosal o [(etilmercuri)thio] 2 benzoato de sodio (ácido etilmercuritiosalicílico) es un componente organomercurial. Contiene 49,6% de mercurio por peso. Su fórmula molecular es C9H9HgNaO2S y su estructura química es la siguiente(6):
Se le conoce también como: thiomersal (Europa), tiomersal, thimerosal (Estados Unidos), timerosal, thimerosol, thiosalicilato etilmercúrico de sodio, merthiolate, merthiolato de sodio, mercuriotiolato de sodio, etcétera.
Uso farmacéutico
En preparaciones farmacéuticas el timerosal se ha utilizado como conservante de productos farmacéuticos. Ha sido usado en muy pequeñas cantidades en vacunas (véase más adelante) desde la década de 1930. En aplicaciones tópicas ha sido usado como fungicida o antibacteriano (gotas oftálmicas). La actividad antibacteriana está relacionada con la liberación del etil-Hg después de la ruptura espontánea y enzimática del timerosal en etil-Hg y tiosalicilato. A pH ácido el timerosal es bactericida. A pH alcalino o neutro es bacteriostático y fungistático.
Metabolismo
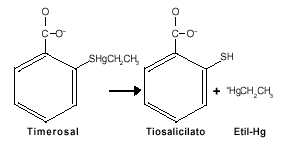
El timerosal se transforma en el organismo en etil-Hg y tiosalicilato(7):
La información actual es limitada en cuanto a las diferencias potenciales de los efectos entre el etil-Hg y el tiosalicilato. El etil-Hg, como todo derivado del mercurio, puede acumularse en animales y en el hombre.
Diferencias entre el etilmercurio y el metilmercurio
Los compuestos orgánicos del mercurio son químicamente muy inestables. El MeHg es el compuesto orgánico del mercurio más estudiado por su efecto nocivo. Existe cierta equivalencia entre el etil-Hg y el MeHg, ya que ambos tienen una estructura química muy similar, por lo tanto se considera que el etil-Hg también se transformaría en mercurio inorgánico. A altas dosis, ambos están asociados con neurotoxicidad. El MeHg puede ser absorbido por ingestión, inhalación y a través de la piel. Se distribuye en todos los tejidos, pero se concentra en el sistema nervioso central (SNC) y en la sangre. En los eritrocitos se concentra en una relación aproximada de eritrocitos/plasma de 20:1(3). Del MeHg, 90% es excretado por las heces a través de la bilis, mayormente como Hg inorgánico. Menos de 10% aparece en la orina. El Hg es oxidado a catión inorgánico divalente (Hg2+) en los eritrocitos, pulmón e hígado. Una vez convertido en Hg2+, su penetración a través de la barrera hemato-encefálica es mínima(4). El Hg orgánico también se une al glutation y a otras proteínas del plasma, como la metalotioneina, proteínas que pueden jugar un papel protector evitando el transporte de Hg fuera de las células. El MeHg en el torrente sanguíneo se incorpora al cabello. Debido a la gran cantidad de grupos sulfhidrilos que el cabello contiene y a la alta afinidad del Hg por estos grupos se puede encontrar Hg en el cabello en una proporción con respecto a la sangre de 250-300:1, por lo que este representa un indicador biológico de exposición al mercurio. Por lo tanto, el crecimiento reciente del cabello refleja la concentración de Hg en sangre más reciente. Como el cabello crece alrededor de 20 cm/año, se puede obtener un antecedente de exposición analizando la presencia de Hg a diferentes segmentos del mismo(3).
No se ha establecido la toxicidad comparativa entre el etil-Hg y el MeHg. Sin embargo, sobre la base de la limitada información disponible, algunos expertos concluyeron que los efectos nocivos del etil-Hg pueden ser similares a los del MeHg.
¿Cómo afecta el mercurio al organismo?
Existen diversas teorías. La producción del Hg inorgánico a partir de mercurio orgánico (MeHg, etil-Hg) implicaría la producción de radicales libres. Estos radicales libres determinarían la peroxidación lipídica de la membrana celular provocando un daño en la célula(9). Las células más afectadas son las cerebrales, hepáticas y renales (necrosis tubular renal o lesión glomerular ocasionadas por sales inorgánicas de Hg)(3). El órgano blanco del Hg en sus formas inorgánicas es el riñón, pero el MeHg tiene la capacidad de dañar gravemente al SNC en desarrollo, debido a una pérdida de neuronas de la capa granulosa del cerebelo, de la corteza cerebral (en especial el área visual) y de otras áreas. De las células cerebrales, las neuronas son las más sensibles al daño producido por los radicales libres, lo que las hace particularmente sensibles al estrés oxidativo. Sin embargo, el mecanismo exacto responsable de la neurotoxicidad es desconocido y esto dificulta la evaluación. El daño por intoxicación aguda provoca ataxia, escotomas y disminución del campo visual(9). El primer efecto que aparece a dosis más bajas es la parestesia de manos y pies. Otras manifestaciones clínicas del efecto del mercurio son: incoordinación, disartria, debilidad, pérdida de la visión y audición, espasticidad, temblores, pérdida de memoria, y a muy altas dosis coma y muerte. Estos efectos se producen a dosis muy superiores a las presentes en vacunas. Hasta el momento no existe ninguna evidencia de que la cantidad de mercurio contenido en las vacunas haya producido daños en el sistema neurológico en niños vacunados. Los recién nacidos son potencialmente los más expuestos al riesgo de exposición al Hg, por su sistema nervioso más susceptible, al encontrarse todavía en desarrollo.
Mucho de lo que se sabe sobre los efectos del Hg, específicamente del MeHg, proviene de los episodios de envenenamiento en la bahía de Minamata (Japón), en Irak, Pakistán, Estados Unidos, Guatemala y en otros lugares(2, 3,9-12). Los efectos nocivos del MeHg fueron conocidos a fines de los años 1950 y principios de los años 1960 por el consumo de pescado contaminado en la bahía de Minamata, cuya principal industria era una planta química que arrojaba sus emanaciones directamente al agua de la bahía. La planta usaba mercurio inorgánico y parte de este era metilado antes de ser vertido en la bahía. Se ha descrito que con el tiempo llegaron a intoxicarse 121 personas y 46 murieron(3). Otro incidente ocurrió en Irak en 1972. En otoño de 1971, Irak importó gran cantidad de semillas de cebada y trigo tratadas con pesticida a base de MeHg y las distribuyó para su siembra en la primavera de 1972. A pesar de las advertencias oficiales, el grano fue molido y la harina se usó para hacer pan. Como resultado, más de 6.500 personas fueron hospitalizadas y 500 fallecieron. Durante estos episodios, la exposición materna al MeHg se asoció con alteraciones neurológicas (retardo psicomotor) en niños expuestos in útero. En Alamogordo, Nuevo México (1994), una familia de granjeros presentó toxicidad posterior a la ingesta de carne de cerdo alimentado con granos tratados con MeHg como funguicida(2). Tanto en Irak como en Alamogordo, las personas estuvieron expuestas al Hg por lo menos durante tres meses y presentaron graves manifestaciones, como cuadriplejia, pérdida de la visión, incluso la muerte.
En estudios epidemiológicos más recientes se evaluó el efecto de bajas dosis de exposición al MeHg en la dieta. Estos estudios fueron realizados en las islas Faroe en 1996 en niños menores de 7 años y en las islas Seychelles en niños con igual o menor edad de 9 años. Se evaluaron los efectos neurológicos debidos al MeHg, al que habían estado expuestos los niños in útero, mediante el análisis de sangre del cordón, de cabello de recién nacidos o madres, consumo de pescado por las madres y pruebas neuropsicométricas en los niños(10,11). Estos estudios tuvieron algunas diferencias en cuanto a la edad de los niños evaluados, cantidad de exposición al MeHg, a la forma de medir los niveles de MeHg y a las pruebas neuropsicométricas utilizadas. Los resultados fueron considerados como inconsistentes y no pudo establecerse una correlación entre las anormalidades encontradas y los niveles de MeHg de la dieta(10,11).
Promedio de la vida media biológica en la sangre en adultos
La vida media biológica (T1/2) del MeHg en sangre en adultos es de 40 días a 70 días (rango 20-70 días), en tanto que la del etil-Hg se calcula que es de 30 días - 50 días. Sin embargo, en revisiones recientes realizadas por el grupo de expertos del GACVS se indicó que la farmacocinética del MeHg y del etil-Hg son un poco diferentes, en particular la T1/2 del etil-Hg es corta (menos de una semana) comparada con la del MeHg (1,5 meses), por lo que la exposición al etil-Hg en sangre es relativamente breve(13).
Exposición en niños al MeHg y al etil-Hg(10,11)
En general, la exposición al MeHg a través de la dieta se calcula que es de: 0,02 µg/kg/día - 0,2 µg/kg/día. Basándose en la presunción de exposiciones al MeHg continuas y por períodos prolongados, la exposición máxima permitida recomendada por la Environmental Protection Agency (EPA) es de 0,1 µg/kg/día, la recomendada por la Administración de Alimentos y Medicamentos en Estados Unidos (FDA) es de 0,43 µg/kg/día, valor basado en parte a una ingesta máxima tolerable de 30 µg/kg/día de MeHg, lo que se traduce en este valor, para un adulto de 70 kg. La OMS establece un valor de 3,3 µg/kg/semana, lo que para propósitos de comparación en valores diarios corresponde a 0,47 µg/kg/día. Para la Agency for Toxic Substance and Disease Registry (ATSDR) el valor es de 0,3 µg/kg/día(12). El límite de exposición acumulativa de MeHg calculado para lactantes de 6 meses de edad o menores sin consecuencias adversas para la salud es, según la EPA, de 65 µg, para la FDA (Food and Drug Administration) de 259 µg y para la OMS de 305 µg(9). Estos niveles son considerados hasta diez veces por debajo del límite superior de seguridad(10-12). El uso de vacunas con timerosal como conservante podría resultar en una exposición al Hg durante los primeros 6 meses de vida que excede los niveles de seguridad para el MeHg de la EPA, pero no los de la ATSDR, FDA u OMS. La Academia Nacional de Ciencias, a petición del Congreso de Estados Unidos, estableció que la dosis apropiada de referencia (RfD) de MeHg es la sugerida por la EPA, de 0,1 µg/kg/día(12) y ha sido usada como referencia para evaluar la exposición al mercurio en niños que han recibido vacunas que contienen timerosal(4). El propósito de estas directrices es evitar la exposición de mujeres en edad reproductiva y en embarazadas a cantidades de Hg que podrían resultar tóxicas al cerebro del feto. Estas guías no fueron diseñadas para exposiciones intermitentes. Tampoco hay guías para la exposición al etil-Hg, pero expertos en Estados Unidos están de acuerdo en que las directrices usadas para el MeHg son apropiadas para el etil-Hg.
Usos del timerosal
El timerosal es el conservante más ampliamente utilizado en vacunas. Como conservante, el timerosal puede ser añadido al final del proceso de producción, desde el producto final a granel hasta el envase final o en el diluyente de una vacuna liofilizada(12). El timerosal es usado como un agente inactivador en la fabricación de ciertas vacunas (pertussis acelulares). En este proceso, aun cuando no es usado como conservante, explica la presencia de cantidades mínimas de timerosal en la concentración final en vacunas (? 2µg/timerosal/ml). También es usado para evitar la contaminación bacteriana durante el proceso de producción de algunas vacunas (influenza) y para prevenir la contaminación bacteriana y fúngica de vacunas durante su uso, particularmente de frascos multidosis(12). El uso de conservantes en vacunas se implementó luego de ocurrir accidentes trágicos por la contaminación de frascos multidosis que no contenían conservantes. En Australia, en enero de 1928, durante una campaña de vacunación contra la difteria, de 21 niños vacunados por vía subcutánea, 12 fallecieron a las 24-48 horas por estafilococemia(2,12). En 1968, el Código de Regulaciones Federales de Estados Unidos estableció el uso de conservantes (incluyendo el timerosal) en frascos multidosis de vacunas, excepto para vacunas virales vivas atenuadas, como la polio oral, fiebre amarilla, trivalente viral(12). Si bien la probabilidad de contaminación es muy baja, el uso de conservantes en vacunas en general y en frascos multidosis en particular no elimina la posibilidad de contaminación bacteriana. Existen publicaciones de 1981 y 1993 acerca de infecciones piógenas posteriores a la administración de vacunas DPT que contenían timerosal, por lo que deben manejarse apropiada y cuidadosamente los frascos multidosis una vez abiertos, para evitar la contaminación bacteriana(14,15). Entre los conservantes más comúnmente usados en vacunas están: el timerosal (DPT, influenza, hepatitis B), el 2-fenoxietanol + formaldehído (IPV, hepatitis A, algunas vacunas combinadas), el fenol (fiebre tifoidea, vacuna neumocócica) y el 2-fenoxietanol (pertussis acelulares).
Algunos conceptos importantes en vacunas(16)
1. Thimerosal-free (libre de timerosal). Indica que la vacuna no contiene timerosal, ni como conservante ni como remanente del proceso de elaboración de la misma.
2. Preservative-free (libre de conservante). Indica que no se ha añadido timerosal como conservante a la vacuna, sin embargo ha sido usado durante el proceso de fabricación, por lo que pueden estar presentes trazas de Hg (menores a 0,5 µg/0,5 ml) en el producto final.
3. Reducción del timerosal. Indica que se ha logrado disminuir significativamente la cantidad de timerosal. La vacuna no puede ser considerada como Thimerosal-free.
Estudios acerca del timerosal en vacunas
En la literatura se han descrito respuestas alérgicas al timerosal, principalmente de hipersensibilidad de tipo retardada, con reacciones cutáneas: enrojecimiento y edema en el sitio de inyección, leves, de corta duración (pocos días) y autolimitadas. Algunos autores postulan que el componente tiosalicilato del timerosal es el principal determinante de estas reacciones alérgicas, por lo que hasta hoy día ha sido imposible establecer si las reacciones locales son causadas por el timerosal o por otros componentes de las vacunas(17). Entre agosto de 1997 y marzo de 1998, Stajich y colaboradores realizaron un estudio en Atlanta, en 23 recién nacidos hijos de madre AgsHB (antígeno de superficie para hepatitis B) negativo, 18 prematuros, de ? 1.000 g de peso y 5 a término como grupo control, de ? 3.500 g, vacunados contra hepatitis B dentro de la primera semana de vida(18). A todos se les tomó una muestra de sangre prevacunación. En 15 de los 18 niños pretérmino se pudo obtener la muestra de sangre entre las 24 y 48 horas posvacunación. No hubo diferencias estadísticamente significativas en ambos grupos con respecto a los niveles de Hg prevacunación. Sin embargo, en promedio, los niños pretérmino tuvieron niveles Hg diez veces mayores que los niños a término. Es probable que por su inmadurez hepática los niños pretérmino no sean capaces de sintetizar cantidades suficientes de metalotioneina, lo que resultaría en un aumento de los niveles plasmáticos de Hg. Los niveles de Hg posvacunación fueron significativamente mayores en ambos grupos, siendo tres veces mayores en los niños pretérmino. Los autores concluyen que en los niños pretérmino, quienes tienen per se un riesgo de presentar trastornos neurológicos, no existe información que sugiera una relación causal entre dichos trastornos con las inmunizaciones y que se requieren más estudios en los primeros días o semanas de vida después de la aplicación de vacunas contra la HB con timerosal para evaluar la farmacocinética del mercurio(18). Entre noviembre de 1999 y octubre de 2000, Pichichero y colaboradores realizaron un estudio en el cual evaluaron a 61 niños en total: 20 niños de 2 meses de edad (grupo control), 20 niños de 6 meses que recibieron vacunas con timerosal y 21 niños del grupo control que recibieron vacunas sin timerosal. Las vacunas administradas en ambos grupos fueron DaPT (antidifteria, pertusis y tétanos), Hib (anti Haemophilus influenzae), HB (antihepatitis B) a los 2, 4 y 6 meses de edad(4). Se tomaron muestras de sangre, orina y heces a diferentes tiempos dentro de los 30 días de la vacunación. Se analizaron además fórmulas lácteas, leche materna y cabello materno. Se midió la exposición total del mercurio a los 2 y 6 meses de edad. Se analizó el contenido de Hg en las vacunas, resultando ser exactamente igual a la cantidad de contenido certificada por el fabricante. En 14 de 15 niños del grupo control no se detectó niveles de Hg. Los niveles de Hg en ocho muestras de fórmula láctea examinada fue de menos de 0,5 ng/ml. Los niveles de Hg en orina fueron indetectables en la mayoría de las muestras: 1/12 muestras de los niños de 2 meses de edad, 3/15 en la de los de 6 meses de edad y 1/14 en el grupo control tenían niveles detectables de mercurio. Se detectó Hg en las heces de todos los niños que recibieron vacunas con timerosal, la mayor parte Hg inorgánico, lo que es consistente con la hipótesis de que el tracto gastrointestinal representa una forma posible de eliminación del Hg procedente del timerosal. Los niveles de Hg en niños a término, dentro de los 30 días posvacunación (vacunas con timerosal) estuvieron por debajo de los niveles de seguridad establecidos por la EPA en 5 de 17 muestras de sangre de niños de 2 meses de edad y en 7 de 16 muestras de sangre de niños de 6 meses de edad. Los resultados sugieren que la T1/2 en sangre del etil-Hg administrado parenteralmente como timerosal en niños parece ser más corta que la T1/2 de MeHg en adultos, cercana a siete días. Ya que los niveles de Hg en sangre estuvieron uniformemente por debajo de los niveles de seguridad de la EPA, los autores sugieren que el timerosal presente en vacunas de rutina representa un muy bajo riesgo en lactantes a término, pero que vacunas conteniendo timerosal no deberían ser administradas a prematuros de muy bajo peso al nacer. Posteriormente a estos hallazgos, se decidió realizar estudios de farmacocinética que incluyan muestras prevacunación y muestras longitudinales. Se dio inicio a un estudio similar con fondos del Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID), en alrededor de 200 niños, que está siendo realizado por investigadores de Buenos Aires, Argentina, debido a que en Estados Unidos ya no se administran vacunas pediátricas que contengan timerosal como conservante dentro del calendario nacional de inmunizaciones(12).
Cálculo del contenido de timerosal en las vacunas
Aproximadamente 50% (49,6%) del peso del timerosal es Hg. Una solución al 0,01% (1 parte por 10.000) de timerosal contiene 50 µg de Hg/ml o 25 µg de Hg/0,5 ml(12). Por ejemplo, cada dosis de vacuna combinada contra la difteria, tétanos, pertusis, hepatitis B y Haemophilus diponible en el calendario oficial de inmunizaciones de Uruguay contiene 25 µg de Hg por cada dosis de vacuna (0,5 ml). La vacuna pediátrica contra la HB contiene 12,5 µg de Hg/0,5 ml. En líneas generales, las vacunas del programa ampliado de inmunizaciones que contienen timerosal son la DPT, hepatitis B, toxoide tetánico y Hib. La aplicación de las mismas en forma separada (DPT, HiB, HB) aumentaría la exposición al timerosal. Afortunadamente, las vacunas actualmente disponibles en forma combinada permiten la aplicación en una sola inyección de todos estos antígenos con una menor exposición al timerosal. En Uruguay, la cantidad de timerosal que reciben los niños a través de las vacunas obligatorias en el calendario oficial vigente de inmunizaciones es de 75 µg, cantidad total presente en las tres dosis de vacuna combinada DTP-HB/Hib aplicada a los 2, 4 y 6 meses de edad. Cabe señalar que Uruguay es el único país en Latinoamérica donde se realiza screening de HB gratuitamente y de rutina a las embarazadas en hospitales públicos como parte del control prenatal, por lo que sólo aquellos recién nacidos hijos de madres AgsHB positivas reciben una dosis adicional de vacuna HB al nacer, que contiene 12,5 µg de Hg. Estos niños, al cumplir 6 meses de edad, habrán recibido como máximo 87,5 µg de Hg.
Cronología de las acciones sugeridas con relación
al timerosal en vacunas
Seguidamente se presentan por fechas las decisiones internacionales y algunas repercusiones que hubo en Estados Unidos y en Europa al cambio/eliminación del timerosal como conservante. Se concluye con la posición actual de la OMS de continuar con el uso de vacunas con timerosal.
En 1997, la FDA solicitó hacer una lista de los medicamentos y alimentos que contenían intencionalmente componentes mercuriales y proveer un análisis cuali-cuantitativo de los componentes de mercurio en esa lista. Los resultados fueron publicados en 1999 y se sugirió que la cantidad de componentes mercuriales usados como conservantes en el futuro debería reducirse y que los productos deberían ser reformulados para eliminar el componente mercurial como conservante(20).
El 8 de julio de 1999, el Comité de Propietarios de Productos Medicinales (CPMP) y la Agencia Europea para la Evaluación de Productos Medicinales (EMEA) publicó la recomendación siguiente: "Para vacunación en lactantes y niños pequeños, aun cuando no hay evidencia del daño causado por el nivel de exposición contenido en las vacunas, sería prudente promover el uso general de vacunas sin timerosal, particularmente para vacunas monodosis. Esto debería hacerse en el menor tiempo posible como medida de precaución. Mientras esto ocurra, es imperativo que la vacunación continúe de acuerdo con los esquemas nacionales de vacunación para prevenir brotes de enfermedades"(21).
El 7 de julio de 1999, la Academia Americana de Pediatría (AAP) y el Servicio de Salud Pública de Estados Unidos (PHS) acordaron recomendar a los productores de vacunas la eliminación del timerosal tan pronto como fuese posible, aun cuando el riesgo de exposición al mercurio a través de la vacunación era potencial(22). Solicitaron formalmente a los productores de vacunas comprometerse en preparar un plan para eliminar o reducir tanto como fuese posible el contenido de mercurio de las vacunas. Recomendaron posponer la primera dosis de HB del nacimiento hasta los 2 meses de edad para los hijos de madres AgsHB(-) y en pretérminos, hasta que alcanzaran un peso de por lo menos 2,5 kg. En el caso de hijos de madres AgsHB(+) de estatus desconocido o en lugares donde de rutina no se llevara a cabo el screening a embarazadas, solicitaron mantener la vacunación de HB desde el nacimiento.
El 8 de julio de 1999, la Academia Americana de Médicos de la Familia y el 20 de octubre del mismo año el Comité Asesor en Prácticas de Inmunización (ACIP) se sumaron a las recomendaciones de la AAP y del PHS(23).
En diciembre de 1999, el Comité Nacional Asesor en Inmunizaciones de Canadá recomendó no cambiar los programas de inmunización infantil existentes en ese país, por tres motivos: 1) ausencia de exposición acumulativa en ocho provincias o de muy baja exposición acumulativa en dos provincias y dos territorios a vacunas con timerosal en niños canadienses; 2) falta de evidencia de daño por exposición al mercurio de vacunas contra la HB con timerosal en niños menores de 6 meses de edad, y 3) falta de disponibilidad en ese momento de vacunas contra la HB sin timerosal(5).
El 14 de enero de 2000, en el Weekly Epidemiological Record (WER), la OMS manifiesta su apoyo a la declaración del 7 de julio de 1999 de la AAP y del PHS, pero subrayando la importancia de continuar con el uso de las vacunas pediátricas actualmente disponibles conteniendo timerosal(26).
El 29 de junio 2000, el Comité Científico para Propietarios de Productos Medicinales de la EMEA (CPMP) declaró todavía vigente la declaración publicada en julio de 1999, pero aclarando que los beneficios de la vacunación, aun con vacunas conteniendo timerosal, superaban los riesgos, si es que había alguno(28).
El 18 de julio de 2000, la FDA declaró que trabajaba para remover el timerosal de las vacunas pediátricas, pero que los padres deberían continuar vacunando a sus hijos, ya que los riesgos de no vacunar a un niño sobrepasaban el riesgo desconocido y mucho menor, si lo había, de exposición al timerosal que contenían las vacunas(28). Esta declaración se debió al impacto negativo que tuvo el cambio de política de vacunación sugerido el 7 julio de 1999. En algunos hospitales de Wisconsin, Oklahoma, Oregon y Michigan se generó gran confusión y como consecuencia de ello se retrasó la primera dosis de vacuna contra HB indistintamente, tanto para hijos de madres AgsHB(-), AgsHB(+) o de serología desconocida, incluso después de contar con vacunas contra HB libres de timerosal(30).
El 1º de octubre de 2001, el CDC publicó las conclusiones del Comité de Revisión de la Seguridad en Inmunizaciones del IOM (Institute of Medicine) que habían sido realizadas en julio de ese año, en base a datos publicados y no publicados para evaluar la relación entre el timerosal en vacunas y sus posibles efectos en el desarrollo neurológico(10,30). El comité de revisión concluyó que la evidencia era inadecuada para aceptar o rechazar una relación causal entre la exposición del timerosal en vacunas pediátricas y trastornos del desarrollo neurológico tales como el autismo, el síndrome de déficit atencional y retardo en el lenguaje. Se requieren más estudios para establecer o rechazar esta relación causal.
El 13 y 14 de junio de 2002 se realizó la cuarta reunión anual en Ginebra del Strategy Advisory Group of Experts (SAGE). En esta reunión, el SAGE concluyó y aconsejó que debido a la seguridad de las vacunas, no había razón para cambiar las actuales prácticas de inmunización con vacunas que contienen timerosal(30). El SAGE fue establecido en 1999 por el director general de la OMS para proveer una guía en el programa de vacunas y biológicos.
El 22 de noviembre de 2002, en el WER, la OMS publicó las conclusiones de la sexta reunión del Comité Consultivo Mundial sobre la Seguridad de las Vacunas (en inglés: GACVS: Global Advisory Committee on Vaccine Safety) efectuada en la sede de la OMS el 20 y 21 de junio de 2002(31). Con respecto a la inocuidad de las vacunas que contienen timerosal, el GACVS concluyó que no hay evidencia actual de toxicidad al mercurio en lactantes, niños o adultos expuestos a vacunas que contienen timerosal y que no había razón para cambiar las prácticas de inmunización actuales con vacunas que contienen timerosal basándose en consideraciones de seguridad. El GACVS fue creado en 1999 por la OMS, pero totalmente independiente de ella, para responder rápida y eficazmente a problemas de potencial importancia global relacionados con seguridad en vacunas(13).
¿Eliminar, disminuir o mantener? Posición actual: mantener el uso de timerosal como conservante
Se han planteado tres estrategias(21, 26-33): 1) la eliminación, con o sin reemplazo del timerosal por otro conservante; 2) la reducción del contenido de timerosal, o 3) mantener el timerosal en las formulaciones actuales de las vacunas. La eliminación del timerosal ha sido posible para algunas vacunas, como las pertussis acelulares, contra la hepatitis B, y contra Hib(5,24,27). Estas vacunas están disponibles en algunos países (desarrollados y en desarrollo) para uso público o privado en presentaciones monodosis. De igual modo, en algunos países ya se dispone de vacunas con disminución del contenido de timerosal (? 1 µg/dosis de 0,5 ml) en lugar de la cantidad habitual (25 µg/dosis de 0,5 mL)(12). Sin embargo, la propuesta de la eliminación del timerosal no ha resultado ser una tarea fácil. La reformulación, con la eliminación del timerosal, requiere de cambios en el proceso de producción para asegurar la pureza, potencia, estabilidad, seguridad y eficacia, ameritando quizás estudios clínicos suplementarios(9). Algunos autores opinan que condenar al timerosal y retirarlo de inmediato de todas las vacunas que lo contengan podría llevar a que vacunas prioritarias en calendarios nacionales de inmunización dejaran de estar disponibles, resultando en una crisis global de desabastecimiento de vacunas, así como también en una pérdida de la confianza del público en las mismas(33). La opción de solo contar con presentaciones monodosis requeriría de un gran aumento en la capacidad de producción, de almacenamiento en las cámaras frías disponibles y en un mayor costo. Por otra parte, la eliminación del timerosal de frascos multidosis replantearía el impacto potencial en la práctica habitual de inmunización, en lo que respecta a las actuales pautas del tiempo en que deben permanecer en uso los frascos multidosis una vez abiertos(34). Incluso podría aumentar el riesgo de contaminación y provocar enfermedades tan severas como el síndrome de shock tóxico(33). El balance del riesgo teórico del timerosal es sobrepasado por los beneficios de la vacunación para la prevención de enfermedades graves. Esto favorece fuertemente hoy día a continuar con el uso de vacunas con timerosal en aquellos lugares donde todavía no se dispone de vacunas libres de timerosal dentro de los calendarios oficiales de inmunización, en especial en países en vías de desarrollo, en los cuales los frascos multidosis son la mejor opción para mantener y cumplir con los programas por su costo menor(33). Mientras tanto, la posición actual de la OMS es clara: recomienda mantener el uso de las vacunas con timerosal, especialmente en los países en desarrollo, para continuar con el exitoso programa de control de enfermedades transmisibles, prevenibles mediante vacunación(5,33).
Summary
Thimerosal, a mercury derivative, has been used in the medical field because of its antiseptic properties. Since at least 60 years it has been used as a preservative in vaccines to prevent bacterial contamination, particularly in multidose containers. However, by the end of the 90's it has been questionned in the United States and Europe due to its theoretic risks and neurological effects in infants. Since 2001, international organizations, NGOs and government organizations, and WHO's committees have been reviewing available information on this issue. According to their reports, there is no evidence of harm caused by mercury in children nor in adults who have received thimerosal-containing vaccines. Thus, immunization with thimerosal-containing vaccines do not need to be changed.
Résumé
Le timérosal, dérivé du mercure, a été utilisé en médecine par ses propriétés antiseptiques. Depuis plus de 60 ans il a été utilisé comme conservant dans des vaccins pour éviter la surcroissance bactérienne, spécialement dans des flacons multidose. Pourtant, depuis la fin des années 90, son emploi a été mis en question aux Etats- Unis et en Europe pour le risque théorique d'exposition chez les petits enfants, avec ses effets potentiels sur le développement neurologique. Cette mise en question a poussé les organisations internationales, gouvernementales et pas gouvernementales, parmi lesquelles des groupes de l'OMS, depuis 2001, à réviser l'information disponible. Ces groupes de spécialistes ont conclu qu' actuellement il n'existe pas d'évidence du risque par exposition au mercure chez les enfants et les adultes qui reçoivent des vaccins avec timérosal et, par conséquent, il n'existe pas de motif pour changer les pratiques actuelles d'immunisation avec des vaccins qui contiennent du timérosal.
Bibliografía
1. Diccionario Terminológico de Ciencias Médicas. 11a ed. Barcelona: Salvat, 1974: 617.
2. Mark Smith C. Mercury in Massachussets: An evaluation of sources, emissions, impacts and control. Massachussets Department of Environmental Protection (MADEP). Office of Research and standard. Aug 8, 1996. http://www.testfoundation.org/thimerosal.htm [Consulta: 11 oct. 2001, 14 feb. 2003].
3. Klaassen C. Metales pesados y antagonistas de los metales pesados. In: Goodman A, Rall T, Niess A, Taylor P. eds. Las bases farmacológicas de la terapéutica. 8 ed. México: Médica Panamericana, 1991: 1543-6.
4. Pichichero ME, Cernichiari E, Lopreiato J, Treanor J. Mercury concentrations and metabolism in infants receiving vaccines containing thiomersal: a descriptive study. Lancet 2002; 360(9347): 1737-41.
5. Bigham M, Copes R, Srour L. Exposure to thimerosal in vaccines used in Canadian infant immunization programs, with respect to risk of neurodevelopmental disorders. Can Commun Dis Rep 2002; 28(9): 69-80.
6. Budavari S, O'Neil MJ, Smith A, Heckelman PE, Kinneary J. The Merck Index. 12 ed. New Jersey: Merck 1996: 1590.
7. Martindale. The extra pharmacopoeia. 30 ed. London: The Pharmaceutical Press, 1993: 804.
8. Valeri A. Thiomersal nei vaccini: il meccanismo del danno. http://www.vaccinetwork.org/archivio/thimerosal/2001/integrazesposto.html. [Consulta: 17 feb. 2003].
9. Ball LK, Ball R, Pratt D. Review article: An assessment of thimerosal use in childhood vaccines. Pediatrics 2001; 107(5): 1147-54.
10. Institute of Medicine (USA). Timerosal-containing vaccines and neurodevelopmental disorders. Institute of Medicine. USA. http://www.iom.edu/IOM/IOMHome.nsf/ [Consulta: 7 ago. 2001].
11. The National Academy of Sciences. EPA's Methylmercury guideline is scientifically justifiable for protecting most Americans, but some may be at risk.
http://www4.nationalacademies.org/news.nsf/ [Consulta: 2 oct. 2001].
12. Food and Drug Administration: Center for Biologics Evaluation and Research (CBER): Thimerosal in vaccines. http://www.fda.gov/cber/vaccine/thimerosal.html [Consulta: 16 feb. 2003].
13. World Health Organization. Global Advisory Committee on Vaccine safety, 20-21 June 2002. Wkly Epidemiol Rec 2002; 77(47): 389-90.
14. Bernier RH, Frank JA, Nolan TF Jr. Abscesses complicating DPT vaccination. Am J Dis Child 1981; 135(9): 826-8.
15. Simon PA, Chen RT, Elliot JA, Schwartz B. Outbreak of pyogenic abscesses after diphteria and tetanus toxoids and pertussis vaccinnation. Pediatr Infect Dis J 1993; 12(5): 368-71.
16. National Network for Immunization Information: Mercury in vaccines: What we know. http://www.immunizationinfo.org/features/index.cfm? ID=34 [Consulta: 2 oct. 2001].
17. Goncalo M, Figueredo A, Goncalo S. Hypersensibility to thimerosal: the sensitizing moiety. Contact dermatitis 1996; 34(3): 201-3.
18. Stajich GV, López GP, Harry SW, Sexson WR. Iatrogenic exposure to mercury after hepatitis B vaccination in preterm infants. J Pediatr 2000; 136(5): 679-81.
19. NEWSRx: Childhood Immunization: Mercury in vaccines is at safe levels. Vaccine Weekly. January 1st, 2003. http://www.NewsRx.com [Consulta: 1 feb. 2003].
20. Food and Drug Administration (FDA). Center for Drugs Evaluation and Research (CDER): Mercury compounds in drugs and food. http://www.fda.gov/cder/fdama/mercuryreport.htm [Consulta: 14 feb. 2003].
21. The European Agency for the Evaluation of Medicinal Products (Emea): Public Statement on thiomersal containing medicinal products. London, 8 July, 1999 Doc Ref: EMEA/20962/99. http://www.emea.eu.int/pdfs/human/press/pus/2096299EN.pdf [Consulta: 17 set. 2003].
22. Control Disease Center (CDC). Notice to readers: thimerosal in vaccines: a Joint Statement of the American Academy of Pediatrics and the Public Health Service. MMWR 1999; 48(26): 563-5.
23. American Academy of Family Physicians. Thimerosal in vaccines. Joint statement of the AAFP, the American Academy of Pediatrics (AAP), the Advisory Committee on Ommunization practices (ACIP) and the United States Public Health Service (PHS). http://www.aafp.org/x1566.xml [Consulta: 15 feb. 2003].
24. Control Disease Center (CDC). Recommendations Regarding the use of vaccines that contain thimerosal as a preservative. MMWR 1999; 48(43): 996-8.
25. World Health Organization. Thiomersal as a vaccine preservative. Wkly Epidemiol Rec 2000; 75(14): 12-6.
26. The European Agency for the Evaluation of Medicinal Products (EMEA). Position Statement. Recent developments concerning thiomersal in vaccines. Doc Ref: EMEA/CPMP/1578/00. http://www.emea.eu.int/pdfs/human/press/pus/157800en.pdf [Consulta: 17 set. 2003].
27. Food and Drug Administration (FDA). Statement by William Egan PH.D acting office director of vaccine research and review FDA Department of Health and Human Services, July 18, 2000. http://www.fda.gov/ola/2000/vaccines.html [Consulta: 24 jul. 2000].
28. Control Disease Center (CDC). Timerosal & Vaccines: A new Institute of Medicine (IOM) Report. Immunization Safety Review: Thimerosal-containing vaccines and Neurodevelopmental disorders (2001). http://www.cdc.gov/nip/news/iom-thim10-1-01.htm [Consulta: 25 oct. 2001).
29. Control Disease Center (CDC). Impact of the 1999 AAP/USPHS Joint Statement on Thimerosal in Vaccines on Infant Hepatitis B Vaccination Practices. MMWR 2001; 50(6): 94-7.
30. World Health Organization. Vaccines and Biologicals: Recommendations from the Strategic Advisory Group of Experts. Wkly Epidemiol Rec 2002; 77(37): 305-6.
31. World Health Organization. Global Advisory Committee on Vaccine Safety, 20-21 June 2002. Wkly Epidemiol Rec 2002; 77(47): 389-404.
32. Clements CJ, Ball LK, Ball R, Pratt D. Thiomersal in vaccines. Lancet. 2000; 355(9211): 1279-80.
33. Pless R, Risher JF. Mercury, infant neurodevelopment, and vaccination. J Pediatr 2000; 136(5): 571-3.
34. World Health Organization. Policy Statement: The use of opened multi-dose vials of vaccine in subsequent immunization sessions. WHO/V&B/00.09.Geneva: WHO, 2000.