Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.18 no.1 Montevideo mayo 2002
Evaluación de tecnologías de salud
Dras. Marisa Buglioli Bonilla1, Ana Pérez Galán2
Resumen
La evaluación de tecnologías en salud registra un desarrollo creciente a nivel de los sistemas de salud. El presente trabajo de revisión busca sistematizar tanto los aspectos conceptuales, como la base metodológica utilizada, los diferentes componentes que incluye el área, y las principales tendencias observadas. El objetivo principal es contribuir a la comprensión del alcance y la utilidad del resultado del proceso de evaluación en los distintos niveles de toma de decisión en salud: definición de políticas, gestión de servicios de salud y para el ejercicio de la práctica médica.
Puede afirmarse que la evaluación de tecnologías se ha convertido en una verdadera especialidad en el área de la salud. El objeto de la evaluación tiende cada vez más a la integralidad, abarcando no solamente medicamentos y equipos médicos, sino también acciones preventivas, procedimientos de mediana y alta complejidad e inclusive modos de organización en salud. El proceso de evaluación de tecnologías de salud se refiere tanto a las nuevas tecnologías como a las ya existentes, debido a la incertidumbre sobre su efectividad o en casos menos frecuentes por la demostración de efectos adversos que superan a los beneficios esperados.
Palabras clave: EVALUACIÓN DE TECNOLOGÍA BIOMÉDICA.
URUGUAY.
1. Máster en Economía de la Salud y Gestión Sanitaria – Universitat Pompeu Fabra de Barcelona.
Profesor Adjunto del Departamento de Medicina Preventiva y Social – Facultad de Medicina. Universidad de la República Oriental del Uruguay.
2. Máster en Sistemas de Atención a la Salud – Universidad de Montreal. Ex Asistente del Departamento de Medicina Preventiva y Social – Facultad de Medicina. Universidad de la República Oriental del Uruguay.
Correspondencia: Dra. Ana Pérez. Asilo 3336. Montevideo-Uruguay. E-mail: aperez@chasque.apc.org
Recibido: 04/09/01.
Aceptado: 22/03/02.
Concepto
En las últimas décadas se asiste a un proceso de desarrollo a nivel mundial del número y complejidad de los procedimientos de diagnóstico y terapéutica, de la demanda de la población por servicios de salud y de la superespe-cialización de los recursos humanos del sector salud(1).
Este proceso se acompaña del advenimiento de una corriente crítica con respecto a la organización del sector y sus prestaciones. En este sentido se ubica gran parte de la investigación biomédica y de salud pública más reciente. El nivel de análisis puede situarse desde el impacto específico de una técnica en las células del cuerpo humano, hasta el impacto generado por el cambio en las políticas de salud con respecto al uso de los servicios de salud.
El incremento registrado en los costos se señala como el principal determinante que habría estimulado el interés en los países industrializados en la investigación con respecto a la eficacia y la calidad de los servicios de salud.
Según la Oficina de Evaluación Tecnológica del Congreso de Estados Unidos (OTA) se define la tecnología de la salud como "los medicamentos, dispositivos médicos y quirúrgicos utilizados en la atención médica y los sistemas organizacionales y de soporte al interior de los cuales se provee dicha atención".
Si bien existen variaciones con respecto a la amplitud del concepto de tecnología en salud, el concepto más aceptado implica un importante grado de especialización del personal de salud involucrado en este tipo de prestaciones, así como una utilización intensiva de equipamiento(2).
Cabe destacar que de acuerdo a la opinión de algunos autores un gran porcentaje de la tecnología del sector salud no se generó a partir de la investigación biomédica, sino que resulta de la transferencia de tecnologías que fueron desarrolladas fuera del sector. En este sentido se mencionan: el láser, el ultrasonido, la resonancia magnética y la principal incorporación tecnológica del sector: la informática(3).
En los países subdesarrollados el modelo de utilización de tecnología está afectado por las características de la transferencia tecnológica, en la medida que la producción local se restringe a un porcentaje mínimo del total del equipamiento disponible. Se destaca la incidencia de factores tales como el marco regulatorio, las políticas de intercambio comercial, las estrategias de las empresas productoras y las características de los recursos humanos y físicos locales.
La evaluación de tecnologías en salud (ETES) se define como la forma integral de investigar las consecuencias clínicas, económicas y sociales del empleo de las tecnologías en salud y sus efectos directos e indirectos, deseados y no deseados.
La evaluación de tecnologías en salud se caracteriza por constituir un vínculo o "puente" entre la ciencia y las políticas de salud(4). Se distingue de este modo del resto de la investigación en salud por su orientación política(5).
Mientras que los investigadores del área de la salud persiguen como objetivo primario un incremento en el conocimiento, los evaluadores de tecnologías de salud desean producir información útil para la toma de decisiones políticas, como la cobertura de los seguros de salud, la asignación de recursos, etcétera.
El desarrollo de la evaluación de tecnologías abarca diferentes niveles según Battista(2):
– nivel de políticas de salud (macro): orienta en las directivas a adoptar en lo que respecta a la asignación de recursos, regulación y sistemas de reembolso,
– nivel institucional (meso): facilita el gerenciamiento de las instituciones,
– nivel clínico (micro): colabora en la toma de decisiones clínicas a través de la difusión de guías clínicas.
Según los diferentes contextos y tendencias se realiza –a través de un abordaje multidisciplinario– la evaluación de los equipamientos utilizados, los medicamentos, los procedimientos diagnósticos y terapéuticos, y las diferentes formas de organización de los servicios de salud.
Existe consenso en señalar que la evaluación de tecnologías en medicina difiere de la evaluación de tecnología en la mayor parte de las ramas de la industria en por lo menos tres elementos(6):
– el proceso de evaluación es técnicamente muy complejo,
– la existencia de seguros de salud o cobertura estatal reduce los incentivos para los pacientes para realizar análisis de costo-efectividad de las distintas alternativas tecnológicas,
– el mercado de la salud se encuentra extremadamente fragmentado.
Cabe destacar que la problemática de la variabilidad de la práctica médica ha sido identificada como uno de los aspectos principales que condicionan la evaluación de tecnologías en salud (este aspecto será desarrollado más en detalle en el punto 4).
Las grandes diferencias encontradas en la utilización de tecnologías se han atribuido a factores condicionantes tales como(7,8): la dotación de recursos humanos y materiales de salud; las características del sistema de salud y las formas de remuneración de sus técnicos; las características epidemiológicas de los pacientes (edad, sexo, morbilidad, características sociales y culturales); el desarrollo de instituciones educativas, la utilización de protocolos clínicos en la práctica médica y la presión ejercida a los médicos por sus pares, por los pacientes o por la industria.* Pero también se ha señalado como un factor relevante las características propias de los médicos ("incorporadores tempranos" e "incorporadores tardíos")** que los hacen más o menos entusiastas frente a la implementación de innovaciones tecnológicas.
Por otro lado se describe la dinámica de incorporación de tecnología como paradójica en cuanto a los gastos que implica: las aplicaciones que van reduciendo sus costos como la angioplastia y la colecistectomía laparoscópica, de igual modo aumentan los gastos porque se amplían sus indicaciones y su uso se extiende progresivamente a una población más amplia a la que originariamente estuvieron destinadas(3).
Para varios autores(9-11) la difusión de nuevas tecnologías en salud debe interpretarse en la dicotomía constante entre ciencia y arte que caracteriza a la práctica médica. Se destaca que la difusión está directamente vinculada a las estrategias que asumen los médicos para manejar una de las características básicas de la profesión: la incertidumbre, "el laboratorio o la radiología son usados para alcanzar una ilusión de certidumbre, reduciendo la complejidad del diagnóstico y tratamiento a simples indicadores". Los rápidos avances de la medicina habrían potenciado la división ya insinuada en la medicina occidental, entre la visión del paciente como una persona y la visión del paciente como un conjunto de signos y síntomas.
El reciente desarrollo de guías o protocolos clínicos emergen de esta forma como un vínculo relevante entre la práctica y el conocimiento en medicina, en la medida que sistematizan la mejor evidencia disponible en las distintas áreas(10). Constituyen de este modo una herramienta para reducir las incertidumbres de la ciencia médica y resultan uno de los puntos de intersección entre evaluación de tecnologías y garantía de calidad de atención.
* La velocidad con la que las nuevas tecnologías se difunden actualmente se encuentra en proporción directa con el grado de competencia de la industria y del mercado.
** En el área de prevención se ha observado en Canadá que la adopción precoz de técnicas preventivas se encuentra asociada con variables demográficas: las mujeres jóvenes presentan mayor tendencia a adoptarlas(2).
Métodos utilizados en la evaluación de tecnologías
Los métodos utilizados* para la evaluación se orientan generalmente hacia la consolidación de la mejor evidencia disponible para lo que es necesario recolectar, analizar y sintetizar información de la mejor calidad disponible. En términos generales estos se clasifican según la utilización de datos primarios y secundarios(12).
Los métodos que utilizan datos primarios parten de la base de la existencia de registros de incidencia y prevalencia de los fenómenos que estudian, aunque estas determinaciones no son consideradas métodos de evaluación en sí mismas. Dentro de este grupo se describen:
– ensayos clínicos controlados, se caracterizan porque su diseño experimental riguroso intenta minimizar las variaciones producidas por factores independientes del factor analizado (los sesgos) al asignar sujetos randomizados a distintos grupos,
– evaluación de tecnologías diagnósticas, se basa en la identificación de la sensibilidad y especificidad de los tests diagnósticos así como en la determinación del valor predictivo positivo o negativo,
– estudios de series de casos de patologías determinadas en su evolución temporal,
– otros diseños epidemiológicos, se utilizan también los métodos clásicos de la epidemiología tales como estudios de cohortes, caso-control, etcétera,
– estudios de vigilancia epidemiológica que monitorean la incidencia de casos específicos,
– análisis de bases de datos informáticas que contienen información clínica y de gestión,
– encuestas que pueden proveer información sobre utilización, prevalencia, difusión, actitudes y costos.
Los métodos secundarios basan su eficacia en la calidad de los datos primarios que resumen. Los siguientes son los principales métodos utilizados:
– revisiones de la literatura, resumen la información disponible en diversos estudios sobre la misma temática,
– meta-análisis, consisten en el proceso de combinación de estudios, teniendo en cuenta los resultados obtenidos, el tamaño de las muestras utilizadas en cada uno, así como aspectos de calidad de los estudios como el diseño, el sesgo, etcétera(13),
– grupos de expertos: grupos Delphi, grupos nominales y conferencias de consenso,
– modelización matemática, puede representar en forma abstracta las interrelaciones entre variables.
* Por razones de extensión nos limitamos a enumerar los principales métodos utilizados.
Evidencia y grados de recomendación
Las diferentes alternativas de lo que podría resultar un tratamiento eficaz deberían someterse a rigurosas pruebas antes de su aceptación en la práctica clínica cotidiana. Los ensayos clínicos controlados son el patrón oro para las comparaciones de los efectos del tratamiento a lo largo del tiempo, y siempre que estén disponibles deberían tener la preferencia ante otro tipo de información. Aunque estos estudios puedan resultar costosos y difíciles, la alternativa (tratamientos sin suficiente evidencia) puede serlo aun más(14).
Las ventajas de un ensayo clínico controlado son suficientes como para ser considerado el estudio de referencia. Obtiene una distinción especial con relación a otro tipo de diseño debido a que la intervención se asigna de manera aleatoria y por consiguiente sin sesgos.
Para aprovechar el potencial de diferentes ensayos clínicos controlados publicados sobre un tema se realizan los llamados meta-análisis, con el objetivo de resumir los resultados de toda la información procedente de estudios consistentes desde un punto de vista científico. Un requisito básico es que los estudios que incluya deberán ser homogéneos (similares en cuanto a características de los pacientes, intervenciones y medida de resultados).
Entre las limitaciones de los ensayos clínicos controlados se destacan las siguientes:
– puede no existir el número suficiente de pacientes con la enfermedad en cuestión para llevar a cabo el estudio;
– el costo de realizarlos en general es muy elevado;
– pueden transcurrir muchos años antes de obtener resultados;
– nos informan sobre los beneficios de un tratamiento durante el período de tiempo de duración del ensayo, pero dichos beneficios o sus reacciones adversas pueden variar a lo largo del tiempo(15);
- el conjunto de los resultados de estos estudios puede, eventualmente, no ser generalizable a algunos casos individuales. Puede existir variabilidad en el efecto del tratamiento dependiendo –por ejemplo– del nivel de riesgo basal, determinando que haya pacientes en los que resulta inefectivo y otros donde se obtiene un mayor beneficio(16). Los beneficios de una nueva medida terapéutica son en general demostrados en pacientes en situaciones extremas de la enfermedad, donde es también mayor el poder de la estadística para mostrar el efecto de las intervenciones.
Para muchas decisiones sobre tratamientos no se dispone de evidencia procedente de ensayos clínicos controlados. En estos casos se utilizan otras fuentes de información por lo que se trata de un análisis secundario de datos (responder la pregunta sobre la eficacia del tratamiento no fue la causa que originó la recolección de los datos).
Entre sus ventajas se destacan las siguientes:
– disponer de un número importante de casos (habitualmente se recurre a grandes bases de datos previstas para facturar los gastos de la asistencia recibida o para la administración);
– permitir trabajar con subgrupos de pacientes;
– los resultados pueden ser más generalizables que en los ensayos clínicos controlados al proceder la información de contextos naturales de la organización sanitaria;
- el costo es muy inferior y las conclusiones pueden obtenerse en un período más breve.
Los inconvenientes se relacionan con las ventajas de los ensayos clínicos controlados: es más común la presencia de diferentes sesgos que no permiten realizar comparaciones entre distintas alternativas; los datos no cuentan con la calidad de un diseño de ensayo clínico y pueden faltar variables que sean de interés analizar.
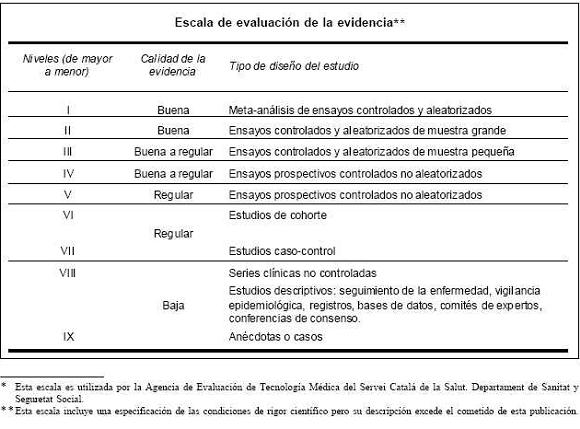
Las agencias de evaluación de tecnología médica realizan una valoración y clasificación de la evidencia sobre una tecnología determinada, utilizando distintas escalas basadas en el rigor científico y la calidad de la evidencia disponible. A continuación se presenta un ejemplo de las escalas utilizadas.*
En cuanto a la calidad de la evidencia su interpretación es la siguiente: buena, cuando la evidencia científica es adecuada, regular si existe cierta evidencia, y baja, la evidencia es insuficiente para recomendar o desaconsejar la adopción de la tecnología(17).
Si bien los ensayos clínicos controlados nos aportan la mejor evidencia sobre los beneficios y daños de un tratamiento, la aplicación de dichos resultados a los pacientes individuales puede tener algunas dificultades tanto en lo relativo a la presentación como a la interpretación de los resultados, aspectos en los cuales no es posible profundizar en esta revisión.
Componentes de la evaluación
Se sintetizan a continuación los elementos más utilizados actualmente en evaluación de tecnologías de salud:
La seguridad es la medida o evaluación del daño inducido por la aplicación de la tecnología en cuestión. El efecto esperado por el uso de la tecnología debería superar en forma evidente el riesgo potencial de su aplicación. Este componente es fundamental debido a que todas las tecnologías, especialmente las terapéuticas, suponen algún riesgo vital del sujeto al que se le aplican.
La eficacia mide la probabilidad de que un individuo, en una población definida, se beneficie de la aplicación de una tecnología médica en la resolución de un problema de salud determinado bajo condiciones ideales de actuación. En tanto la efectividad es la probabilidad de que individuos de una población definida obtengan un beneficio de la aplicación de una tecnología médica en un problema determinado en condiciones normales o prácticas de uso. El concepto de efectividad, diferenciado del de eficacia, explica la dificultad de hacer afirmaciones definitivas acerca del beneficio real para la salud de una tecnología, aunque haya estado en uso por muchos años.
El impacto organizativo, ético y social adquiere relevancia creciente ante la convicción de que no todo lo técnicamente posible es sanitariamente útil y éticamente aceptable. En lo ético, el análisis abarca desde la polémica sobre la introducción de innovaciones tales como la fecundación "in vitro" hasta la discusión sobre la asignación de recursos en el sector salud asegurando la cobertura de determinados procedimientos para determinada población.
El análisis económico incluye al menos cuatro herramientas clásicas de evaluación:
– La minimización de costos parte del supuesto de que las alternativas diagnósticas o terapéuticas evaluadas tienen exactamente el mismo efecto.
– El análisis costo-beneficio se distingue porque tanto el numerador como el denominador del ratio se expresan en términos monetarios, lo que permite la comparación de programas con diferentes unidades de medida de efectividad. En salud se observa un uso creciente sobre todo por la extensión de la técnica de valoración contingente (disponibilidad a pagar por la obtención de un resultado favorable en el estado de salud).
– En el análisis de costo-efectividad se mide el efecto en unidades naturales de efectividad (morbilidad, mortalidad, casos tratados, etcétera).
– Los estudios de costo-utilidad presentan la ventaja de incorporar el concepto de calidad de vida en la medición del efecto. Relaciona las diferencias entre costos y años de vida ganados ajustados por utilidad, producidas por dos o más intervenciones.
Utilización de la evidencia:
variabilidad de la práctica médica
La problemática de la variabilidad de la práctica médica ha sido identificada, en general, como uno de los aspectos que condicionan la evaluación de tecnologías en salud.
De acuerdo a lo que se señalara precedentemente (punto 1) las grandes diferencias encontradas en la utilización de tecnologías han sido atribuidas a diversos factores condicionantes tales como recursos, organización del sistema de salud, desarrollo de instituciones educativas y características epidemiológicas de la población.
Las variaciones en la práctica médica pueden definirse como las variaciones sistemáticas (es decir no aleatorias) en las tasas estandarizadas para determinados tratamientos (o procedimientos diagnósticos) para un determinado nivel de agregación de la población(18).
Se cita al trabajo de Glover, en el año 1938, sobre la incidencia de tonsilectomía y la variabilidad debida a diferencias de opinión médica* como la primera investigación en el área(19). Pero sólo a partir de los años 70 se aplica el "bisturí a fondo" en el tema a partir de Wennberg y sus estudios en Estados Unidos, y posteriormente otros investigadores en Canadá, Reino Unido, Noruega, Francia y Bélgica. La variabilidad se demuestra tanto en procedimientos médicos como quirúrgicos, en las distintas especialidades y subespecialidades, así como en pacientes internados o ambulatorios(20). Las diferencias de utilización pueden reflejar sobreutilización en unas zonas (las de altas tasas), así como subutilización en otras (las de menores tasas), ya que la diferencia de morbilidad en poblaciones grandes tiende a desaparecer.** Se postula como variable explicativa de las importantes diferencias encontradas, el estilo de práctica médica.
Si bien parte de la variabilidad se ha asociado a diferencias en la oferta de recursos, y a la presencia de cuidados innecesarios, la hipótesis de mayor aceptación se relaciona con la discrecionalidad de las decisiones clínicas individuales o estilos de práctica médica(21).
* "...existe una tendencia a practicarla como ritual profiláctico de rutina sin ninguna razón ni ningún resultado en particular...".
** Esto no significa que la diferencia en morbilidad no sea uno de los factores explicativos más importante cuando se analiza la utilización de servicios en casos individuales.
McPherson(18) plantea que desde el punto de vista epidemiológico pueden identificarse tres causas de variaciones sistemáticas: incertidumbre en casos de investigación insuficiente; ignorancia clínica, por insuficiente divulgación de la investigación o porque el resultado de la misma no se entiende o no se cree; o que se trate de la manifestación de preferencias informadas.
Se observa menor variabilidad cuando existe consenso entre los clínicos, y mayor en casos de alta incertidumbre. Se describe alta variabilidad de la cirugía electiva, en particular histerectomías, amigdalectomías y prostatectomías en casos de hiperplasia benigna; siendo menor en la cirugía de urgencia, por ejemplo apendicectomías.
En los tratamientos médicos la variabilidad también es alta, la otitis media aguda es tratada con antibióticos en 98% de los casos en Nueva Zelanda, mientras sólo 31% de los niños ingleses los reciben para dicha afección. Varían los criterios diagnósticos (18 diferentes criterios son descritos), el nivel de certidumbre con el que se inicia el tratamiento, así como el antibiótico seleccionado. Ante la existencia de mayores dudas con respecto al diagnóstico, mayor es la tasa de utilización de antibióticos(22).
¿Cuál es el problema? La variabilidad estaría indicando que frente a situaciones similares se adoptan estilos de práctica diferentes; esto genera dudas ante la indicación de ciertas intervenciones, los resultados obtenidos en los pacientes en función de la utilización de una u otra práctica, así como sobre la eficiencia del empleo de los recursos.
De la investigación se desprende que la variabilidad de la práctica médica estaría en parte explicada por las distintas opiniones de los médicos acerca de las diferentes alternativas diagnósticas y terapéuticas para un mismo problema de salud. Cuando no existe evidencia científica suficiente sobre los resultados de dichas alternativas (incertidumbre), o si existiendo evidencia científica el médico no la utiliza (ignorancia*) se originan estas diferencias de opinión.
Peiró y Meneu(23) describen dos estrategias de abordaje diferentes para cada situación. Cuando existe evidencia clara sobre la efectividad de un procedimiento pero la misma se ignora, es necesaria una mayor difusión de la información, desarrollar programas de formación continuada, establecer mecanismos de feed-back sobre los resultados obtenidos e instrumentar la revisión de utilización junto al desarrollo de incentivos para promover la utilización apropiada.
Ante situaciones de alta incertidumbre se propone promover la investigación sobre eficacia, efectividad y costo-efectividad de intervenciones alternativas, y, mientras tanto, aumentar la capacidad de elección por parte de los pacientes así como la promoción de consensos de expertos hasta que la ciencia aporte evidencia sobre el procedimiento.
* Algunos ejemplos de evidencia científica disponible pero no conocida o no utilizada por tiempo: efecto de los corticoesteroides en la prevención del parto prematuro; eficacia del empleo de trombolíticos en los IAM.
Organismos encargados de la evaluación
de tecnologías en salud
La evaluación de tecnologías creció a partir de los años 70 en los países desarrollados como una multiplicidad de programas y organizaciones que desarrollan, sintetizan y diseminan información sobre la utilidad de los procedimientos y prácticas utilizados en los servicios de atención a la salud(24). Identificadas genéricamente como Agencias de Evaluación de Tecnologías, sus objetivos han sido principalmente los de proveer información fidedigna sobre la efectividad, los costos, los efectos adversos y las consecuencias éticas y sociales de las tecnologías sanitarias a los tomadores de decisiones(25).
Estos organismos nacionales o regionales(26) se han desarrollado a través de distintas formas de organización: unidades de los ministerios de salud; agencias privadas; unidades en el marco de organizaciones profesionales; agencias dependientes de instituciones aseguradoras; unidades de las universidades y agencias dependientes de instituciones benéficas.
Según los contextos sanitarios en los que se insertan las Agencias de ETES, los enfoques del trabajo han sido diferentes poniendo mayor o menor énfasis en aspectos tales como la producción de reportes con resultados de investigación primaria (ensayos clínicos, etcétera) o secundarios (revisiones), la diseminación de información o la regulación.
El itinerario de Canadá en los últimos 20 años se describe a través de procesos paralelos en lo académico y lo gubernamental, donde se destaca la influencia que la ETES adquirió en la definición de políticas de salud(26). En lo años 70 se impulsó con especial énfasis a nivel académico el área de investigación. En la década del 80 se produjo la participación con la Colaboración Cochrane a través de grupos que comenzaron a trabajar en el análisis de la evidencia científica (grupos Cochrane), para finalmente consolidarse en los 90 el ámbito de Medicina Basada en la Evidencia (Evidence Based Medecine). A nivel gubernamental, por otro lado, se generaron en los años 80 numerosas agencias federales de evaluación de tecnologías con énfasis en el análisis secundario de la evidencia generada, en gran parte en el ámbito académico nacional, que comenzaron a tener importante incidencia en las instancias de regulación del sector salud. Estas agencias dieron lugar posteriormente a la coordinación de agencias estatales (Canadian Coordination for Health Technology Assessment).
En Estados Unidos(26) el desarrollo de la ETES se produjo precozmente con la creación de la Oficina para la Evaluación de Tecnologías, dependiente del Congreso (Office for Technology Assessment) que funcionó entre 1972 y 1978. Los distintos organismos que funcionaron a partir de éste (National Center for Health Technology, Office of Health Technology Assessment, Agency of Health Care Policy and Research), sufrieron la presión de los distintos actores para imponer su visión en función de sus intereses en la toma de decisiones en el sector. Se señalan, sin embargo, como elementos favorecedores hacia una racionalidad en la asignación de recursos en salud en este país, la disposición de instituciones de investigación de alto nivel y de organismos evaluadores de tecnologías, la implementación de uno de los sistemas de información en salud más completos y el desarrollo específico de destrezas gerenciales.
En España, a partir de 1984, algunas Regiones Autónomas implementaron en forma descentralizada actividades de ETES como respuesta a contextos socioeconómicos y sanitarios particulares. Es el caso de Andalucía, Cataluña y País Vasco(27). A nivel nacional la regulación de los servicios brindados por el Sistema Nacional de Salud se realiza a través del Grupo de Trabajo en Evaluación de Tecnologías, que es un grupo asesor del Consejo Interterritorial de Salud, que abarca a las distintas regiones.
Las Agencias de ETES existentes en España presentan distintos estatus jurídicos y se encuentran constituidas por un staff fijo de investigadores que solicita la colaboración de consultores o paneles de expertos según las necesidades planteadas. El énfasis fundamental está puesto en las revisiones de bibliografía y la necesidad de traducción a nivel local de estos resultados a través de análisis económicos, legales, etcétera. Igualmente existe una preocupación creciente por el desarrollo de estrategias de difusión de la información producida.
En el Reino Unido, a pesar de constituir el punto principal de desarrollo de la investigación primaria en los años 80, la ETES fue reconocida recientemente como una herramienta importante en la definición de políticas de salud. Este proceso se produjo en paralelo a la reforma implementada en el Sistema Nacional de Salud que promovía la creación a su interior de un "mercado interno"(26). La ETES en el Reino Unido abarca no sólo evaluación de drogas y equipamiento sino todo el espectro de la práctica médica. Constituye tanto investigación primaria como revisiones de evidencia pre-existente especialmente impulsadas por la Colaboración Cochrane y el Centro de Revisión y Diseminación del Sistema Nacional de Salud(28). Existe una multiplicidad de productores de ETES donde es posible observar el funcionamiento de todo el espectro de modalidades organizacionales que describiéramos. La estrategia gubernamental ha sido la de establecer coordinaciones entre las diversas unidades, más que la de generar un organismo estatal con rol preferencial en esta materia. El Consejo de Investigación Médica es la principal agencia a través de la cual el gobierno financia la investigación biomédica y clínica, e igualmente existe un programa del Sistema Nacional de Salud de Evaluación de Tecnologías desde 1992. Los organismos estatales actuarían como favorecedores y como coordinadores del pluralismo existente en cuanto a métodos de revisión de la evidencia y formas de difundirla.
El enfoque general ha sido el de identificar las prioridades en la asignación de recursos y detectar los gastos innecesarios del sistema.
Finalmente cabe destacar la existencia de diversas entidades internacionales que han potenciado los esfuerzos nacionales:
– ISTAHC (International Society of Technology Assessment of Health Care): sociedad creada en 1985 de libre afiliación con el propósito de difundir evaluaciones de tecnologías entre investigadores y tomadores de decisiones.
– INAHTA (International Network of Agencies for Health Technology Assessment): organización nacida en 1993 que incluye actualmente 30 países de Europa, América, Asia y Oceanía. Está integrada por organizaciones sin fines de lucro que tienen al menos un 50% de financiación pública. La pertenencia a la red permite compartir la información producida por cada Agencia, pero además se han iniciado proyectos conjuntos de evaluación por grupos de Agencias.
– COLABORACIÓN COCHRANE: reúne a diferentes centros de todos los continentes (en América Latina el grupo que ha adquirido mayor desarrollo es el de Brasil que recopila y analiza sistemáticamente información científica procedente de ensayos clínicos controlados).*
* Funciona en la Universidad Federal de San Pablo. Su página web es www.centrocochranedobrasil.org
Principales tendencias
De la misma manera que se señala que el sistema de salud es un "sistema de enfermedad", el énfasis de la ETES ha estado ubicado principalmente en las tecnologías innovadoras que involucran equipamiento costoso y personal superespecializado(29).
En países como Canadá, Suecia y el Reino Unido existe una tendencia creciente en los últimos años a abordar integralmente temas de salud, tratando aspectos preventivos, curativos y de rehabilitación.
El área de los exámenes preventivos ha sido explorada en numerosas evaluaciones, particularmente la del grupo de trabajo sobre prevención de Estados Unidos (U.S. Prevention Task Force) demostrando que estos estudios se introducen precozmente, muchas veces, sin evaluaciones adecuadas. Se intenta explorar la validez de las prácticas preventivas en términos de calidad de vida y costo-efectividad(29).
Del mismo modo se comienza a jerarquizar el área de rehabilitación en países como Suecia y Dinamarca, en base al impacto progresivo de las enfermedades crónicas. En este sentido se han incorporado temas tales como patologías de la columna, diabetes, enfermedades mentales y rehabilitación de patologías neurológicas.
El objeto de la evaluación resulta cada vez más amplio: medicamentos, equipamiento, prácticas preventivas, procedimientos de mediana o alta tecnología, o modos de organización en salud.
Se presentan a continuación, y a modo de ejemplo, algunos de los temas abordados por el programa de ETES del Sistema Nacional de Salud del Reino Unido que dan cuenta de esta diversidad que se señala:
– revisión sistemática del costo-efectividad de la angina crónica estable,
– comparación controlada de las alternativas terapéuticas en la rehabilitación de accidentes vasculares encefálicos,
– organización e impacto de centros de emergencia en el primer nivel de atención,
– costo-efectividad de la resonancia magnética en el diagnóstico de enfermedades de la articulación de la rodilla,
– análisis de costos del seguimiento médico-preventivo de los niños,
– revisión sistemática del trasplante de médula ósea y "stem cells",
revisión sistemática de la evidencia sobre los efectos de la incorporación del paciente a la toma de decisión clínica.
Aunque las revisiones sistemáticas generalmente se focalizan en datos cuantitativos, se han comenzado a abordar análisis de aspectos cualitativos, generalmente en vinculación con evaluaciones organizacionales.
Los motivos para desarrollar procesos de ETES han sido variados según los casos. En las tecnologías ya existentes, el posible planteo de retiro de financiación en tecnologías que se demuestren ineficientes, o en casos menos frecuentes, el retiro de una tecnología del mercado en razón a que sus efectos secundarios superan a los beneficios esperados. Con respecto a las nuevas tecnologías, la evaluación se relaciona con el requerimiento de aprobación para el acceso al mercado, la toma de decisión con respecto a su inclusión entre las prestaciones financiadas con fondos públicos, así como su adecuada difusión dentro del sistema sanitario.
En este sentido se observa una tendencia a interesarse por tecnologías ya incorporadas y no sólo por las innovadoras. La Cochrane Collaboration desarrolló una línea específica de recuperación de ensayos clínicos controlados en referencia a tecnologías en uso en los sistemas de salud.
En Holanda un estudio Delphi identificó 194 tecnologías que se usan actualmente en ese país y que requerirían –según los expertos consultados– ser sometidas a procesos de ETES.
Se observa igualmente un desplazamiento de la forma más habitual de evaluación, la dirigida a una tecnología única, a la evaluación de grupos de tecnologías relacionadas, o incluso evaluaciones de sistemas y modos de organización.
Por otro lado, cabe señalar la existencia de un desarrollo específico más allá del área de elaboración de recomendaciones, en lo que respecta a la profundización de estrategias de educación, difusión e implementación de los resultados de los informes.
Este tema surge con especial interés en la medida que se asume que la regulación en el área médica no es sinónimo de adopción de determinadas prácticas, en la medida que lo que está en juego es el desarrollo de una práctica profesional con una fuerte tradición de autonomía y libertad clínica.
Finalmente se constata que las formas de uso de las tecnologías, los resultados clínicos alcanzados y los costos asociados cambian continuamente. En esta línea algunos autores plantean la necesidad de desarrollar un modelo de evaluación que contemple revisiones periódicas durante el ciclo de vida de una tecnología, ajustando la dinámica de las evaluaciones a la de las variaciones tecnológicas(3).
El desarrollo de la ETES podría constituirse en una respuesta apropiada en los próximos años a los desafíos que se plantean en los servicios de salud debido tanto a los cambios epidemiológicos sufridos por nuestra población, como a las crecientes dificultades económico-financieras que se registran en varias de las instituciones de salud de nuestro país(30,31).
Desde el punto de vista metodológico el camino más factible parece ser –para el caso uruguayo– el de profundizar principalmente en la investigación secundaria, revisando la evidencia que surge de los estudios primarios de otros países (ensayos clínicos controlados, etcétera) y contextualizándola a la realidad de nuestro país, a sus características epidemiológicas y organizacionales, entre otras.
Summary
Health technologies assessment is an increasingly important issue in health systems. This review looked at concepts, methods, components and trends related to this area. The main aim was to enhance results of assessments at diverse levels: policy making, health management and medical practice. Health technologies assessment has become a speciality in the health field.
The purpose of the assessment currently tends to integrate not only drugs and medical equipment but also prevention, procedures and health organization. Assessment involves new generation of advanced technology as well as the currently used since effectiveness and adverse effects may be evaluated.
Résumé
L’évaluation des technologies au domaine de la santé montre un développement croissant dans les systèmes de santé. Ce travail de révision cherche à systématiser les aspects conceptuels ainsi que la base méthodologique employée, les différents composants de ce domaine et les principales tendances observées. Le but en est de contri-buer à la compréhension de l’utilité du résultat du processus d’évaluation dans les différents niveaux de prise de décision en santé: définition des politiques, gestion des services de santé et exercice de la pratique médicale.
On peut affirmer que l’évaluation des technologies est devenue une véritable spécialité au domaine de la santé. Le but de l’évaluation vise de plus en plus à l’intégralité, comprenant pas seulement les médicaments et les équipements médicaux mais aussi les actions de préven-tion, les procédés de moyenne et haute complexité et même les modèles d’organisation à la santé. La période d’évaluation des technologies de santé fait allusion aux nouvelles technologies et à celles qui existaient déjà, étant donné l’incertitude sur leur effectivité ou, en certains cas moins nombreux, la démonstration des effets adverses qui avantagent les bénéfices espérés.
Bibliografía
1. Battista RN, Contandriopoulos A-P, Champagne F, Williams JI, Pineault R, Boyle P. An integrative framework for health-related research. J Clin Epidemiol 1989; 42(12): 1155-60.
2. Battista RN. Innovation and diffusion on health related technologies. Int J Technol Assess Health Care 1989; 5: 227-48.
3. Geljins A, Rosenberg N. The dynamics of technological change in medecine. Health Aff 1994; 13: 28-46.
4. Battista RN. Towards a paradigm for technology assessment. Scientific Basis of Health Services. London: BMJ Publishing Group, 1996: 11-8.
5. Battista RN, Jacob R. Evaluation and regulation of the health care system: the inescapable challenge. Ann R Coll Physicians Surg Can 1994; 27(8): 464-8.
6. Fuchs VR, Garber AM. The new technology assessment. N Engl J Med 1990; 323(10): 673-7.
7. Mc Pherson K, Strong PM, Epstein A, Jones L. Regional variations in the use of common surgical procedures: within and between England and Wales, Canada and the United States of America. Soc Sci Med 1981; 15: 273-88.
8. Blais R. Variations in surgical rates in Quebec: does access to teaching hospitals make a difference? Can Med Assoc J 1993; 148(10): 1729-36.
9. Greer Al. The state of the art versus the state of the science. Int J Technol Assess Health Care 1988; 4: 5-26.
10. Battista RN, Hodge M, Vineis P. Medecine, practice and guidelines: the uneasy juncture of science and art. J Clin Epidemiol 1995; 48(7): 875-80.
11. Grimshaw JM, Russell IT. Achieving health gain through clinical guidelines: ensuring guidelines change medical practice. Qual Health Care 1994; 3: 45-52.
12. Deber RB. Choices in methods of technology assessment and their impact on decision making. Symposioum on Health Care Technologies assessment, Quebec: 1989: 33-42.
13. L’Abbé KA, Detsky AS, O’Rourke K. Metaanalysis in clinical reserach. Ann Intern Med 1987; 107: 224-33.
14. Fletcher RH, Fletcher SW, Wagner EH. Epidemiología Clínica. 2a ed. Madrid: Masson-Williams & Wilkins, 1998: 141-70.
15. Laupacis A, Sackett D, Roberts R. An assessment of clinically useful measures of the consecuences of treatment. N Engl J Med 1988; 318: 1728-33.
16. Rothwell PM. Can overall results of clinical trials be applied to all patients? Lancet 1995; 345: 1616-19.
17. Jovell AJ, Navarro Rubio MD. Evaluación de la evidencia científica. Med Clín (Barcelona) 1995; 109: 740-3.
18. McPherson K. Cómo debería modificarse la política sanitaria ante la evidencia de variaciones en la práctica médica. Variaciones en la Práctica Médica (Instituto Valenciano de la Salud Pública) 1995; 7:9-17.
19. Glover JA, Kerr L. White. La incidencia de tonsilectomía en niños de edad escolar. In: White R. Investigaciones sobre Servicios de Salud: una Antología. Washington: OPS 1992: 18-31. (Publ Científica 534).
20. Chassin MR, Brook RH, Park RE, Fink JK, Kosecoff J, Solomon DH, et al. Variations in the use of medical and surgical services by the medicare population. N Engl J Med 1986; 314: 285-90.
21. Peiró S, Meneu R, Marqués Espí JA, Librero J, Ordiñana R. La variabilidad en la práctica médica: relevancia, estrategias de abordaje y política sanitaria. In: Valle Sánchez V. Papeles de Economía Española. Madrid, 1998: 165-75.
22. González-Vallejo C, Sorum PC, Stewart TR, Chessare JB, Mumpower JL. Physicians’ diagnostic judgments and treatment decisions for acute otitis media in children. Med Decis Making 1998; 18: 149-62.
23. Peiró S, Meneu R. Revisión de la utilización. Definición, concepto y métodos. Rev Calidad Asistencial 1997; 12: 122-36.
24. Jacob R, Battista RN. Assessing technology assessment: Early results of the Quebec Experience. Int J Technol Assess Health Care 1993; 4: 564-72.
25. Jacob R, Mc Gregor M. Assessing the impact of health technology assessment. Int J Technol Assess Health Care 1995; 11(2): 287-300.
26. Battista RN, Hodge MJ. The development of health technology assessment: Int J Technol Assess Health Care 1997; 13(1): 68-80.
27. Granados A, Asúa J, Conde J, Vázquez-Albertino R. Health Technology Assessment in Spain. Int J Technol Assess Health Care 2000; 16(2): 532-59.
28. Woolf S, Chirs H. Health Technology Assessment in the United Kingdom. Int J Technol Assess Health Care 2000; 16(2): 591-625.
29. Banta D, Oortwijn W. Health Technology Assessment and Health Care in the European Union. Int J Technol Assess Health Care 2000; 16(2): 626-35.
30. Lazarov L, Buglioli M. Fondo Nacional de Recursos. Montevideo: Sindicato Médico del Uruguay, 1997.
31. Pérez A, Buglioli M, Gianneo O, Berterretche R, Jones JM, Vainer C, et al. "Evaluación de la Tecnología Médica en el Uruguay". Proyecto de Investigación financiado por la Comisión Sectorial de Investigación Científica. Montevideo: Universidad de la República, 1997-1998.