Introducción
La piomiositis (PMS) es una infección bacteriana aguda o subaguda del músculo esquelético estriado que se acompaña en ocasiones de abscedificación1. Se estima que su incidencia se encuentra en aumento, observándose en Australia incrementos de 2,04 a 8,73 casos por 10.000 niños, entre los años 2002 y 20122. En Argentina se reportó en 2019 una tasa de hospitalización de 21,5 casos por 10.000 niños al año3. No existen estudios de incidencia en Uruguay.
La PMS en países de clima templado ocurre con mayor frecuencia en adultos de sexo masculino, en países tropicales afecta predominantemente a niños de 2 a 5 años y adultos de 33 a 40 años1-5.
El principal agente etiológico es Staphylococcus aureus, independiente del estado inmunológico del paciente. Esta entidad puede clasificarse en primaria o secundaria. La PMS primaria ocurre cuando una bacteriemia transitoria siembra en un sitio de traumatismo previo, lesión muscular o ejercicio intenso. La PMS secundaria podría ser consecuencia de la extensión directa de un proceso infeccioso contiguo renal, óseo o intestinal4-9.
Inicialmente, la PMS fue descrita como una enfermedad tropical, pero su incidencia ha aumentado en países de climas templados como consecuencia de la emergencia de Staphylococcus aureus meticilino resistente adquirido en la comunidad (SAMR-AC)2,10. Las infecciones causadas por SAMR-AC, productor de leucocidina Panton-Valentine, se asocian a la formación de abscesos, evolución clínica tórpida, niveles aumentados de marcadores inflamatorios, mayores complicaciones y hospitalizaciones prolongadas2,5,11,12.
Las manifestaciones clínicas son variables y dependen del tiempo de evolución, predominando el dolor, impotencia funcional, cojera, edema y fiebre, pudiendo manifestarse de forma tardía con sepsis y shock séptico1,8.
La resonancia magnética (RM) se considera el estudio de elección para realizar un diagnóstico precoz, evaluar extensión y descartar diagnósticos diferenciales1.
El tratamiento consiste en antibioticoterapia en base a las resistencias locales y drenaje quirúrgico en caso de formación de abscesos11,13.
Objetivo
Presentar el caso clínico de un niño pequeño con diagnóstico de PMS multifocal y describir su abordaje diagnóstico y terapéutico.
Caso clínico
Niño de 3 años, previamente sano. Buen crecimiento y desarrollo. Esquema de vacunación vigente. Antecedente ambiental: padre cursó infección de piel y tejidos blandos abscedada dos semanas previas a la consulta. Medio socioeconómico y cultural deficitario, hacinamiento.
Inició seis días previos al ingreso hospitalario con fiebre continua con varios registros diarios de hasta 39 °C, sin chuchos, acompañados de rinorrea serosa. A las 48 horas, agregó dolor difuso en ambos miembros inferiores, de intensidad leve a moderada, que calmaba con antiinflamatorios no esteroideos, cojera y repercusión general dada por astenia, adinamia y anorexia.
Examen físico. Constantes vitales: frecuencia cardíaca 105 latidos por minuto, frecuencia respiratoria 18 respiraciones por minuto, TAX 36 °C, presión arterial 90/57 mmHg, saturación de oxígeno con oxímetro de pulso de 96%, ventilando espontáneamente al aire. Palidez cutánea, no mucosa. Bien hidratado y perfundido. Lesiones impetiginizadas costrosas múltiples en miembros inferiores (pierna y muslo), sin lesiones ampollares, acompañadas de pequeños hematomas en diversos estadios evolutivos. Asimetría de miembros inferiores a expensas de aumento del tamaño del muslo izquierdo. A la palpación de cara interna de muslo izquierdo en tercio superior, se constató tumoración de límites difusos de 13 x 5 cm, ovalada, lisa, firme, adherida a planos musculares, dolorosa. Sin edema, calor ni rubor. Dolor a la palpación de cadera izquierda, pubis y a la movilización pasiva y activa de cadera. Miembro inferior derecho y columna sin edema, calor, rubor, ni dolor. A la marcha se evidencia cojera. Examen cardiovascular: ritmos bien golpeados, no soplo. Examen pleuropulmonar, abdominal y neurológico, normal.
Valorado en conjunto con traumatología se solicitaron exámenes de laboratorio e imagen. Del laboratorio se destaca: hemoglobina 10,9 g/dl, glóbulos blancos 30.100/mm3, neutrófilos 67%, plaquetas 540.000/mm3, proteína C reactiva (PCR) 305 mg/L, velocidad de eritrosedimentación (VES) 40 mm/h.
Radiografía de pelvis: ambas caderas de morfología y estructura normales. Sin lesiones óseas. Aumento de partes blandas en región superior e interna del muslo izquierdo. Ecografía de cadera y muslo: extensa tumoración sólida de ecoestructura heterogénea en muslo izquierdo, con compromiso de aductores, de 10 cm de diámetro longitudinal y 5 cm de transversal. No se visualizaron colecciones líquidas a dicho nivel.
Con planteo de miositis, sin poder descartar el compromiso osteoarticular, se decide ingreso a cuidados moderados, inicia antibioticoterapia empírica con clindamicina y cefuroxime endovenoso, y se solicita RM de muslos y cadera.
RM de muslos y cadera: a izquierda extenso edema de tejidos blandos y de planos musculares. Colección compleja intramuscular de 7 x 4 cm con contenido líquido hiperintenso en T2 e intenso fenómeno de restricción en difusión-adc. A la derecha, alteración muscular similar asociada a la presencia de colección de 2 x 7 cm. En la musculatura paravertebral lumbar baja izquierda, área de edema muscular con colección sólida de 2 cm de diámetro (Figuras 1 y 2).
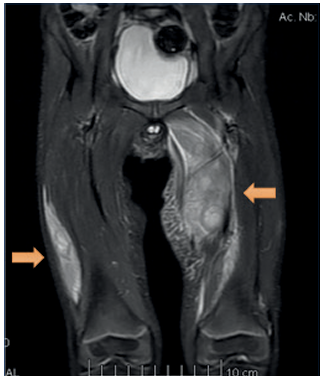
Figura 1 Resonancia magnética de muslo y cadera. En muslo izquierdo se reconoce extenso edema en logia de aductores con presencia de colección compleja intramuscular. A la derecha, la alteración muscular afecta el vasto externo.
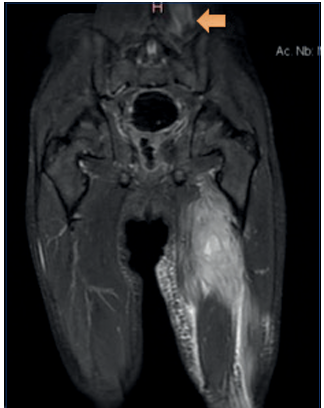
Figura 2 En la musculatura paravertebral baja izquierda se observa área de edema muscular con colección sólida.
Se realizaron drenajes quirúrgicos en tres oportunidades, se extrae líquido purulento. Los hemocultivos fueron sin desarrollo. Se identificó SAMR-AC en el cultivo del drenaje quirúrgico, sensible a eritromicina, clindamicina, gentamicina y trimetoprim sulfametoxazol, se continuó el tratamiento con clindamicina.
Se solicitó ecocardiograma: anatómicamente normal, no identifica vegetaciones valvulares o en otras localizaciones. Estudios de valoración de la inmunidad: anticuerpos para virus de la inmunodeficiencia humana (VIH) negativo; poblaciones linfocitarias, dosificación de inmunoglobulinas, proteinograma electroforético y test de dihidrorodamina normales.
RM de cuerpo entero, a las dos semanas de iniciado el tratamiento antibiótico, mostró resolución de la colección en muslo derecho, mejoría de la lesión de muslo izquierdo y de la imagen paravertebral lumbar (Figura 3). Se observó el compromiso de un cuarto grupo muscular a nivel paravertebral cérvico-torácica izquierda (Figura 4).
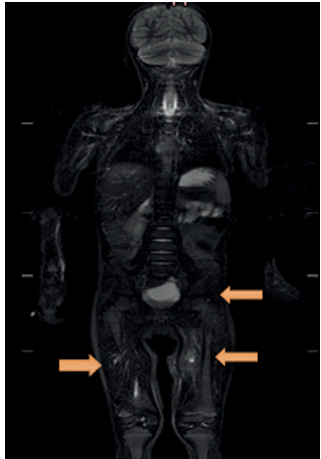
Figura 3 Resonancia de cuerpo entero. Resolución de colección en muslo derecho, mejoría de la lesión de muslo izquierdo y de la imagen paravertebral lumbar izquierda.
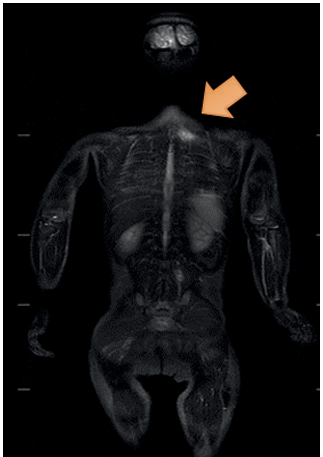
Figura 4 Resonancia de cuerpo entero. Área de edema muscular paravertebral izquierda a nivel cérvico-torácico de 3 cm de diámetro cefalocaudal.
El paciente recibió 17 días de tratamiento endovenoso con clindamicina, continuando con trimetoprim sulfametoxazol oral por 28 días. Previo al alta, se solicitó el consentimiento de la familia para el reporte del caso. Presentó buena evolución, continuó en seguimiento con pediatra y traumatólogo con resolución completa de la miositis multifocal.
Discusión
En la infancia se plantea que la PMS primaria es la forma de presentación más frecuente. La etiopatogenia no es del todo conocida. Solo en 25% de los casos el antecedente de traumatismo como causa de bacteriemia es reportado. El antecedente del trauma en oportunidades no es claro, no se recuerda o no fue presenciado por los cuidadores6,8,9. En el caso presentado, si bien la familia no recordaba un traumatismo de entidad, se trata de un niño pequeño con estigmas en miembros inferiores sugestivos de traumatismos junto a lesiones impetiginizadas. Estas pudieron haber sido la puerta de entrada del patógeno identificado. Otro dato relevante es el antecedente de la infección de piel y tejidos blandos del padre, que sugieren la posibilidad de un ambiente estafilocócico2. Como otros factores favorecedores o de riesgo se describen convulsiones, miositis virales o parasitarias, desnutrición y diversas situaciones de inmunocompromiso primario o secundario1-7.
Esta entidad puede comprometer cualquier músculo o grupo muscular, predominando en las extremidades inferiores y cintura pélvica, siendo menos frecuente su presentación en cráneo y cuello. Los músculos más frecuentemente afectados son cuádriceps, psoas-ilíaco y glúteos. En países tropicales, entre 12% y 43% de los casos son de presentación multifocal y en países templados puede presentarse de este modo hasta en el 60%1,6,8,14,15. El caso reportado tuvo una presentación multifocal con afectación de cuatro grupos musculares diferentes: logia de los aductores izquierda, vasto externo derecho, musculatura paravertebral lumbar izquierda y musculatura paravertebral cérvico-torácica izquierda.
La presentación clínica puede ser inespecífica, predominando la fiebre, el dolor en miembros inferiores y las alteraciones en la marcha. Se describen tres estadios o etapas según el tiempo de evolución: 1) Fase inicial caracterizada por dolor, acompañada o no de leucocitosis leve. 2) Fase supurativa con aumento del dolor, edema y fiebre. 3) Fase tardía de presentación con sepsis y shock séptico1,7,8. En el caso clínico descrito, al momento del ingreso el paciente se encontraba en la segunda fase evolutiva de la enfermedad. Es importante destacar que en etapas iniciales es posible que no todos los abscesos sean superficiales y palpables, es necesario evaluar la presencia de abscesos profundos mediante estudios imagenológicos.
En cuanto a estudios de laboratorio, es frecuente hallar leucocitosis a predominio de neutrófilos, con reactantes de fases agudas elevadas y enzimas musculares generalmente normales. No existen parámetros específicos de laboratorio que orienten a esta entidad, por lo que es necesario un alto índice de sospecha14.
La realización de estudios de imagen es imprescindible para su abordaje diagnóstico y terapéutico. La ecografía suele utilizarse como estudio de primera línea, ya que es un método no invasivo, disponible y de bajo costo8. Sin embargo, a pesar de que puede ver cambios en la ecoestructura del músculo, estos no son fáciles de interpretar y tiene limitación en el diagnóstico de lesiones tempranas. De todos modos, resulta de utilidad para excluir diagnósticos diferenciales, como la artritis o tromboflebitis5,7,14.
La RM actualmente se considera el mejor método para el diagnóstico temprano, capaz de diferenciar pequeños cambios inflamatorios, permite delimitar la extensión del absceso y valorar estructuras adyacentes1,4,6,7,10,15,16. En este caso la ecografía fue orientadora de inflamación, pero el diagnóstico de los abscesos se realizó mediante la RM.
Los hemocultivos fueron sin desarrollo, pero en el cultivo del material purulento drenado de ambos muslos se obtuvo SAMR-AC. Staphylococcus aureus (S. aureus) es el microorganismo más frecuentemente involucrado en esta infección, siendo responsable del 95% de las PMS en países tropicales y en 70% en países de clima templado. Otros patógenos involucrados son Streptococcus pyogenes, Streptococcus pneumoniae, Escherichia coli, Mycobacterium tuberculosis1-17.
En una revisión sistemática publicada en 2021 que incluyó 39 artículos pediátricos, con un total de 361 casos, mostró que el 60% (217) desarrolló S. aureus, 29% (105) no especificados, 26% (93) S. aureus meticilino sensibles, 5,2% (19) S. aureus meticilino resistentes4. Las infecciones vinculadas a cepas de SAMR se asocian a la aparición de complicaciones y diseminación sistémica. Por tal motivo, en este caso se valoró la posibilidad de infecciones en otras logias musculares, compromiso osteoarticular y se descartó endocarditis4,17.
En relación con el tratamiento antibiótico, se sugiere terapia endovenosa empírica, antiestafilocócica, pudiendo utilizarse cefalosporinas de primera o segunda generación, considerando la cobertura de SAMR-AC de acuerdo a las resistencias locales. En circunstancias especiales, como presencia de mal estado general, comorbilidades, o en los menores de 1 año, se debe ampliar el espectro antibiótico a microorganismos anaerobios y gramnegativos. No existe consenso respecto a la duración del tratamiento. Se propone una duración de tres a seis semanas de acuerdo con la evolución clínica7,16-19.
El diagnóstico precoz e inicio oportuno de antibioticoterapia se asocia a mejor pronóstico, pudiendo evitar en oportunidades el drenaje quirúrgico8,20. Sin embargo, dado que la mayoría de las veces el diagnóstico de PMS se realiza con el hallazgo de abscesos musculares, es frecuente que estos pacientes requieran drenaje o punción aspirativa18. Como ocurrió en este caso, el diagnóstico tardío con presentación multifocal requirió, junto a la antibioticoterapia, el drenaje de los abscesos de ambos muslos.
Dado el hallazgo de múltiples abscesos, se sospechó la presencia de una inmunodeficiencia que se descartó con los estudios mencionados. En la mayoría de los casos comunicados los expertos indicaron estudio de evaluación de la inmunidad concluyendo que la PMS ocurre fundamentalmente en pacientes inmunocompetentes21-23.
En general, la PMS presenta un buen pronóstico, el 90% evoluciona a la curación sin secuelas. Las complicaciones más reportadas son osteomielitis, sepsis y artritis séptica4,16. Este niño presentó una buena evolución clínica, sin complicaciones.
Conclusiones
La PMS es una infección en creciente aumento que requiere un alto índice de sospecha dada su presentación clínica y paraclínica inespecífica.
Es indispensable realizar estudios de imagen, siendo la RM el de elección, permitiendo confirmar el diagnóstico, identificar otros focos sin traducción clínica, descartar diferenciales y reconocer complicaciones.
Su tratamiento requiere antibioticoterapia prolongada y drenaje quirúrgico en casos de formación de abscesos. Se sugiere mantener seguimiento estrecho de la evolución clínica inmediata y a largo plazo.















