Introducción
El 11 de marzo de 2020 se declaró como pandemia la enfermedad causada por coronavirus 2019 (COVID-19), causante del síndrome respiratorio agudo severo-2 por el virus SARS-CoV2, que se describió inicialmente en la ciudad de Wuhan (China) en diciembre de 20191.
Desde el inicio de la pandemia, las manifestaciones de COVID-19 en la edad pediátrica han sido más leves en comparación con la población adulta. Sin embargo, se reportan casos de presentación grave en personas jóvenes2-7.
En abril del año 2020, durante el pico de la pandemia COVID-19 producida por el coronavirus emergente SARS-CoV-2, en el Reino Unido se comunicaron casos de shock hiperinflamatorio de características similares a la enfermedad de Kawasaki y el síndrome de shock tóxico en un grupo de ocho niños5-9. El “Royal College of Pediatrics and Child Health” lo denominó síndrome inflamatorio multisistémico (SIM) asociado con COVID-1910. La Organización Mundial de la Salud (OMS), generó las respectivas alertas y lo denominaron síndrome inflamatorio multisistémico asociado a COVID-19 (SIM-C).
El síndrome inflamatorio multisistémico en niños es descrito como un cuadro que aparece entre cuatro a seis semanas posterior a la infección por SARS-CoV-2, caracterizado por fiebre, manifestaciones gastrointestinales como diarrea, vómito o dolor abdominal, criterios de shock y/o enfermedad de Kawasaki3,7-13. Incluso se han reportado alteraciones coronarias, hipercoagulabilidad y parámetros de laboratorio en rango inflamatorio severo, asociado o no a shock4-6,14. Al igual que la enfermedad de Kawasaki, no existen hallazgos patognomónicos o pruebas de diagnóstico para síndrome inflamatorio multisistémico en niños. La OMS definió criterios diagnósticos para este síndrome15.
En algunos estudios no todos los pacientes presentan PCR (reacción en cadena de la polimerasa en tiempo real) positivo para SARS-CoV-2 en el hisopado nasal, pero si tenían evidencia serológica de infección por SARS-CoV-2, o nexo epidemiológico con caso positivo11. Fundamentando esto actuaria que el SIM sería una respuesta inmune retardada a una infección reciente por SARS-CoV-2, no una lesión viral directa3,13-16.
En la Región de las Américas, y hasta el 13 octubre 2020, 16 países/ territorios han notificado a la Organización Panamericana de la Salud (OPS) un total de 1.769 casos de SIM confirmados asociados a COVID-19, incluidas 60 defunciones17.
Las distintas series publicadas le otorgan al SIM-C una mortalidad cercana al 2 %, con una alta incidencia de ingresos a unidades de cuidados intensivos pediátricos y alta proporción de soporte múltiple de órganos9.
El informe epidemiológico sobre COVID-19 en población pediátrica publicado el 7 de setiembre de 2021 en nuestro país, informa 56.579 casos de COVID-19 en menores de 15 años confirmados representando en ese momento el 14.6% del total de casos país18.
Servicio Médico Integral (SMI) es un servicio privado de atención médica integral de nuestro país que asiste aproximadamente a 24.000 usuarios menores de 15 años y a 1000 nacimientos por año.
Desde el inicio de la emergencia sanitaria hasta diciembre 2021 se diagnosticaron 2652 casos positivos confirmados de SARS CoV-2 en menores de 15 años en el SMI de los cuales 6 presentaron SIM-C.
Objetivo
Describir los aspectos clínicos y epidemiológicos del Síndrome Inflamatorio Multisistémico asociado a COVID-19 (SIM-C), en menores de 15 años, en el periodo comprendido entre marzo de 2020 y diciembre de 2021.
Metodología
Estudio observacional descriptivo de una serie de casos en población pediátrica menor de 15 años que cursaron COVID-19 y que posteriormente presentaron manifestaciones clínicas y paraclínicas compatibles con SIM-C en el periodo entre marzo de 2020 y diciembre de 2021.
Se incluyeron a todos los pacientes que se les realizó diagnostico SIM-C.
Los criterios de inclusión fueron los establecidos por la OMS:
Paciente menor de 19 años con fiebre cuantificada por personal sanitario o por un familiar por 3 días o más y dos de los criterios siguientes:
• Erupción cutánea o conjuntivitis no purulenta bilateral o signos de inflamación mucocutánea (boca, manos o pies).
• Hipotensión o shock.
• Datos de disfunción miocárdica, pericarditis, valvulitis o anomalías coronarias (incluidos hallazgos ecocardiográficos o valores elevados de troponina/ NT-proBNP).
• Evidencia de coagulopatía (alteración de tiempo de protrombina, tiempo de tromboplastina parcial activado o valores elevados de dímeros D).
• Síntomas gastrointestinales agudos (diarrea, vómitos o dolor abdominal).
• Valores elevados de marcadores de inflamación (elevación de VES, proteína C reactiva (PCR) o procalcitonina (PCT).
• Ninguna otra causa microbiológica evidente de inflamación, incluida la sepsis bacteriana y los síndromes de shock tóxico estafilocócico o estreptocócico.
• Y evidencia de COVID-19 (RT-PCR, pruebas antigénicas o serología positivas) o contacto probable con un caso de COVID-1915.
Se excluyeron los pacientes que no cumplían con dichos criterios.
Los pacientes se enrolaron a través de los registros médicos. Los investigadores verificaron si cumplían con los criterios de inclusión. La fuente de datos se obtuvo de los registros de las historias clínicas y de laboratorio.
Se registraron las siguientes variables: edad, género, comorbilidades, nexo epidemiológico, fecha de diagnóstico de infección por COVID-19, presencia de síntomas gastrointestinales (diarrea, vómitos o dolor abdominal), compromiso cutáneo/mucoso, afectación ocular (eritema conjuntival), compromiso cardiovascular, vacunas COVID-19 (una o más dosis).
De los datos de laboratorio se describen las siguientes variables: VES, ferritina, D-dímeros, C, PCR, leucocitos y linfocitos. Se consideró infección aguda por SARS-CoV-2 aquellos con test de RT-qPCRy/o test de antígenos y para el diagnóstico de infección pasada o previa determinación de IgM e IgG mediante ensayo de fluorescencia ligado a enzima. Se consideró nexo epidemiológico al antecedente de exposición de riesgo con un caso confirmado. Las variables continuas se describieron mediante mediana y rango y las variables discretas con frecuencias absolutas y relativas.
Para el procesamiento de datos se utilizó el programa Excel.
Los datos de los usuarios se manejaron con total anonimato, salvaguardando la confidencialidad y el secreto médico.
En todos los casos se obtuvo el consentimiento informado de los padres y/o cuidadores.
Aspectos éticos: se aprobó el trabajo con el comité de educación médica que cuenta la institución y la dirección técnica.
Resultados
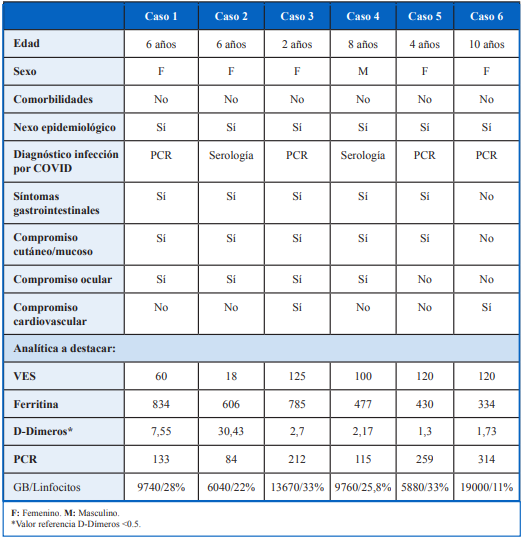
Se describen 6 casos clínicos de SIM-C, en la Tabla 1 se muestra descripción clínica y paraclínica. Presentaron una media de edad de 6 años, 4/6 sexo femenino, sin comorbilidades. Todos fueron asintomáticos en la infección inicial, diagnosticándose la misma en 4/6 mediante hisopado nasofaríngeo por técnica de PCR. En dos pacientes se realiza el diagnóstico por serología. Todos presentan nexo epidemiológico con caso confirmado de SARS-CoV 2.
El intervalo para el inicio de la sintomatología del síndrome inflamatorio fue asintomático en todos los pacientes y tuvo un rango de 9 a 28 días, con una media de 17 días.
Las alteraciones en la paraclínica fueron frecuentes, disminución leve de la hemoglobina, y elevación de los reactantes de fase aguda: proteína C reactiva, velocidad de sedimentación globular, ferritina y dímero D.
Todos los niños presentaron fiebre de más de tres días de evolución siendo este uno de los criterios clínicos de inclusión que define la OMS para SIM-C.
Dentro de los síntomas gastrointestinales que se describen, 5/6 pacientes presentaron dolor abdominal difuso, de leve-moderada intensidad, en dos de estos pacientes el motivo de consulta en el servicio de emergencia fue el dolor abdominal. Las manifestaciones mucocutáneas fueron frecuentes: exantema maculopapular con compromiso en tronco y/o miembros en 5 pacientes, al igual que compromiso ocular: inyección conjuntival no supurativa en 4 pacientes.
La valoración del compromiso cardiaco se realizó en todos los pacientes, mediante marcadores de daño miocárdico, electrocardiograma y ecocardiograma. Se detectó alteración de ecocardiograma en dos pacientes: leve derrame pericárdico en Caso 3 y disfunción sistólica leve, con FEVI de 48% hipoquinesia difusa Caso 6 (Tabla 1).
Los pacientes fueron ingresados a cuidados intermedios por precaución, todos presentaron un cuadro exento de gravedad clínica, sin requerimiento de soporte hemodinámico ni respiratorio. Todos recibieron tratamiento de primera línea con Inmunoglobulinas y corticoides i/v, con buena respuesta clínica en las primeras 24-48 horas de instaurado el mismo, y franca mejoría de las alteraciones en la paraclínica sanguínea en la evolución.
En 3 pacientes (Caso 1, 2 y 6) se administró heparina BPM por tener D dímeros elevados por encima de 5 veces lo normal.
Ninguno de los niños tenía administrada en el periodo del estudio alguna dosis de vacuna para COVID-19.
Discusión
Se desconoce la fisiopatología del SIM-C se sugiere sería resultado de una respuesta inmune anormal al virus12. El pico de casos se daría 2-4 semanas después del pico de casos de COVID-19 en la comunidad, coincidiendo con el momento de la inmunidad adquirida y sugiriendo que se presentaría como complicación postinfecciosa3,9,11,19.
Asistimos a un aumento de los pacientes con esta complicación desde que empezó la pandemia.
La media de edad en nuestro trabajo de 6 años coincide con los reportado en otros trabajos6,13,14. En nuestra serie ninguno de los niños presentaba comorbilidades11. Predominaron los síntomas símil Kawasaki y los síntomas gastrointestinales3-6,12-14,20.
Nuestros hallazgos laboratoriales coinciden con los reportados en otros países y criterios establecidos por la OMS3,12-14,21. Es importante destacar la importancia de realizar un diagnóstico temprano y diferencial con otras enfermedades. Usualmente la EK cursa con anemia, leucocitosis, trombocitosis y marcadores inflamatorios muy elevados; en contraste, la presencia de linfopenia, trombocitopenia, compromiso renal, hepático y pruebas de coagulación alteradas son hallazgos menos frecuentes en EK, pero se han descrito ampliamente en MIS-C3-7,12-14,19.
Respecto a las manifestaciones cardiovasculares que presentaron nuestros pacientes, coinciden con las reportadas en otros trabajos, atribuyéndose las mismas a una respuesta inmune aguda y desregulada, relacionada con la tormenta de citoquinas, daño endotelial, disfunción microvascular y lesión isquémica14,22.
El abordaje de estos pacientes fue realizado por un equipo multidisciplinario incluyendo diferentes especialidades: pediatría, cuidados intensivos, cardiología e infectología.
Los pacientes mantuvieron seguimiento ambulatoriamente al alta por dichas especialidades, con controles clínicos y paraclínicos. Ninguno de ellos presento síntomas digestivos, cutáneos ni respiratorios luego del alta, los controles paraclínicos fueron normales; retomando actividades habituales sin limitaciones funcionales. Los pacientes que presentaron compro- miso cardiovascular (Caso 3-6), presentaron normalización de Ecocardiograma: FEVI normal, cavidades cardiacas de tamaño normal, no derrame pericárdico, no hipertensión pulmonar. En el caso 6, se mantiene la Insuficiencia tricúspidea leve, que no podemos atribuir específicamente a SIM-C.
En nuestra serie los pacientes tuvieron escasa gravedad clínica, no descartando el impacto del diagnóstico y tratamiento precoz en la buena evolución. El total de casos de SIM representó el 0.2% del total de casos confirmados en menores de 15 años.
De todas maneras debido a su potencial gravedad es recomendable que, frente a todo niño con fiebre, síntomas gastrointestinales y mucocutáneos, asociado a exposición al SARS-CoV-2, debe investigarse el compromiso multisistémico para diagnóstico precoz y tratamiento oportuno que mejore el pronóstico.
Es necesario prever esta evolución en pacientes jóvenes, aún en los casos de afectación leve o asintomática de la infección viral, y considerar esta patología en los cuadros clínicos símil Kawasaki.