¿Qué aporta este estudio al conocimiento actual?
Es el primer estudio de nuestro centro que analiza el perfil de cardiotoxicidad subclínica en pacientes sometidos a TPH.
Los hallazgos bioquímicos son comparables a los reportados a nivel nacional e internacional.
Podrían existir diferencias en la cardiotoxicidad subclínica asociada a diferentes regímenes quimioterápicos curativos o de acondicionamiento.
Introducción
Los avances en la detección precoz y las modalidades de tratamiento específico han prolongado la supervivencia de los pacientes hemato-oncológicos, aunque a expensas de un incremento en las complicaciones cardiovasculares (CV). En efecto, la enfermedad CV es la primera causa de muerte entre las personas que sobreviven al cáncer1-3, de modo que los que reciben tratamiento quimioterápico (QMT) tienen 5 veces más riesgo de desarrollar enfermedad CV.
La cardiotoxicidad se define como el desarrollo de enfermedad CV posterior a las terapias oncológicas4. Se produce por efecto directo del tratamiento oncológico o como consecuencia de un desarrollo acelerado de la enfermedad CV. Su espectro clínico, estructural y fisiológico es muy amplio e incluye el desarrollo de disfunción biventricular con o sin insuficiencia cardíaca (IC) clínica, enfermedad tromboembólica, patología pericárdica, isquemia miocárdica, hipertensión arterial (HTA), arritmias y valvulopatías, entre otros5,6. Aunque no existe una definición universal debidamente consensuada, se considera que existe cardiotoxicidad demostrada cuando ocurre un descenso relativo de la fracción de eyección del ventrículo izquierdo (FEVI) > 10% con respecto al valor basal y alcanzando un valor por debajo del límite inferior de la normalidad (53%)7.
Es indudable que se requiere avanzar hacia un cambio en el paradigma diagnóstico de la cardiotoxicidad, pasando de una definición clínico-funcional a una detección de las alteraciones subclínicas tempranas, en un intento por prevenir y detectar de manera precoz el proceso de daño cardíaco y actuar antes de establecida la disfunción sistólica8-10. En esta perspectiva, actualmente se aplican algoritmos de detección y seguimiento que utilizan controles clínicos, dosificación de biomarcadores (troponina y péptido natriurético) y técnicas de imagen, en particular el ecocardiograma Doppler9,11. Varios parámetros ultrasonográficos se utilizan para la detección de cardiotoxicidad, la FEVI es el más utilizado. La evaluación de la deformación o strain longitudinal global (SLG) busca anomalías tempranas en la funcionalidad miocárdica13,14. Así, las alteraciones del SLG ajustadas según edad, sexo y condiciones de carga predicen la caída de la FEVI posterior a la QMT15-17. Además, la disponibilidad del SLG puede tener un valor especial en los sujetos con FEVI limítrofe, en conjunto con la evaluación clínica y bioquímica18,19. Las troponinas son biomarcadores capaces de detectar cardiotoxicidad previa a la disfunción sistólica, independientemente del mecanismo19. Diferentes estudios evidencian que el inicio de tratamiento farmacológico cardioprotector en pacientes con elevación temprana de las troponinas puede prevenir la disfunción sistólica10. Estos resultados han llevado a recomendar la monitorización con troponinas; los protocolos internacionales proponen contar con valores basales y previos a cada ciclo de QMT5,8,11. El péptido natriurético B (BNP), en cambio, es una molécula liberada al torrente circulatorio en respuesta a la sobrecarga de volumen o al aumento de la tensión parietal, lo que sucede de forma temprana en el curso de la disfunción ventricular. Aunque este parámetro bioquímico ha sido ampliamente validado como marcador de IC, son pocos los datos disponibles sobre su utilidad clínica práctica para predecir el desarrollo de cardiotoxicidad20,,21.
El TPH es una modalidad terapéutica potencialmente curativa en múltiples enfermedades hematológicas. El uso progresivo de los regímenes de acondicionamiento con toxicidad reducida y los mejores tratamientos de soporte disponibles han optimizado los resultados de esta modalidad en las leucemias agudas y los síndromes linfoproliferativos22. Sin embargo, el TPH se asocia con toxicidades vinculadas al tratamiento como la cardiotoxicidad, tanto en la etapa aguda postrasplante como a largo plazo22-24. A su vez, quienes sobreviven al cáncer presentan un riesgo de enfermedad CV muy superior a la población general. Se ha confirmado el desarrollo de algún tipo de cardiotoxicidad en hasta un 9% de los pacientes sometidos a TPH, y que esta incidencia es mayor en los que presentan antecedentes de disfunción miocárdica previa22,23. Por desgracia, el enfoque analítico de la cardiotoxicidad bioquímica ha sido escasamente aplicado en los pacientes hemato-oncológicos que reciben TPH tras diversos planes de QMT.
Objetivo
Analizar el perfil evolutivo de liberación de biomarcadores como potencial indicador subclínico de cardiotoxicidad en pacientes sometidos a TPH. Secundariamente se analiza la influencia de diversas variables clínico-oncológicas sobre este perfil bioquímico.
Metodología
Población
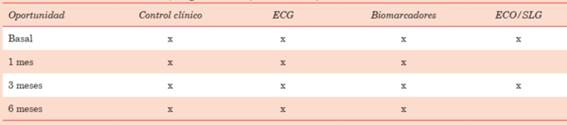
Se incluyeron pacientes sucesivos, mayores de 18 años, portadores de enfermedades hemato-oncológicas en recidiva total o parcial con indicación de TPH, en todas las modalidades de condicionamiento. Todos ellos son asistidos en una policlínica especializada en cardio-oncología, con seguimiento por 6 meses luego del trasplante, en el período comprendido entre octubre de 2018 y marzo de 2020. Se realizaron controles seriados clínicos, electrocardiográficos (ECG), bioquímicos (TnI, BNP) e imagenológicos (ecocardiográficos) según algoritmo elaborado para este subgrupo de pacientes que incluye medidas seriadas en condiciones basales, el primer, tercer y sexto mes postrasplante(25). Se excluyeron aquellos portadores de cardiopatía isquémica, miocardiopatía dilatada no isquémica y cualquier cardiopatía estructural con disfunción sistólica severa del VI (FEVI < 30%).
Seguimiento clínico y bioquímico
Se obtuvo información de la base de datos de la policlínica en variables patronímicas, antecedentes personales, oncológicas (tipo de patología, planes de QMT, tipo de TPH que se va a someter y plan de acondicionamiento), así como parámetros seriados clínicos, ECG, bioquímicos y ecocardiográficos. Se realizó una valoración del estado clínico inicial con estratificación de riesgo CV basal mediante score de Tichelli26 y controles integrales previos al procedimiento, al mes, 3 y 6 meses de este (tabla 1). Se aplicaron los lineamientos generales de los protocolos de valoración, diagnóstico, prevención y tratamiento de la cardiotoxicidad descritos por guías de referencia internacional5.
- Paraclínica basal: TnI, BNP, hemoglobina (Hb).
- ECG de 12 derivaciones en cada control.
- Ecocardiograma Doppler transtorácico (ETT) y SLG, si se dispone.
El diagnóstico de IC se realizó como un síndrome clínico que constaba de síntomas de IC (disnea, fatiga) y signos clínicos (pulmonares o periféricos) apoyados por radiografías de tórax o FEVI reducida (< 50%) o una respuesta beneficiosa al tratamiento médico de la IC. El diagnóstico clínico de IC se realizó a ciegas de los resultados del BNP.
En consonancia con las guías de práctica clínicas actuales, se definió el desarrollo de cardiotoxicidad como un descenso absoluto de 10 puntos porcentuales en la fracción de eyección del VI con un valor final < 53% (límite inferior de la normalidad), asociado o no a la presencia de síntomas de IC7. Sin desmedro de esto, se tuvieron en cuenta también los siguientes criterios complementarios: reducción relativa del SLG > 15% con respecto al basal o ascenso anormal en los biomarcadores (valores alcanzados de TnI >0,04 ng/ml, y de BNP >100 pg/ml).
De acuerdo con las pautas del laboratorio clínico de referencia, se definieron valores normales de TnI como aquellos comprendidos entre 0,00 y 0,04 ng/ml y de BNP entre 0 y 100 pg/ml. Cuando el valor de TnI fue menor a 0,05 ng/ml se computó un valor sérico de 0. Se establecieron los siguientes factores de riesgo cardiovascular (FRCV) para el desarrollo de cardiotoxicidad: edad menor a 15 o mayor a 60 años, sexo femenino, cardiopatía previa (FEVI menor a 53%, coronariopatía, valvulopatías moderadas a severas, miocardiopatía hipertrófica), antecedentes de cardiotoxicidad, tratamiento QMT previo, antraciclinas a dosis altas (doxorrubicina > 250 mg/m2), radioterapia mediastinal a dosis altas (> 30 Gy) y biomarcadores elevados antes del inicio de tratamiento25,26. Se realizó seguimiento clínico en todos los casos, monitorizando presión arterial (PA) y frecuencia cardíaca (FC), electrocardiograma y evaluando el desarrollo de síntomas y signos de IC y seguimiento paraclínico y bioquímico en los tiempos establecidos. Ante el desarrollo de síntomas y signos de IC se indicaron evaluaciones complementarias, según criterio clínico del cardiólogo tratante. En cuanto a la intervención terapéutica, se fomentaron estrategias de estilo de vida saludable, control de FRCV, modificación y tratamiento de estos, ejercicio físico, abandono del hábito tabáquico, inicio de fármacos cardioprotectores (IECA y betabloqueantes) en pacientes con alto riesgo de cardiotoxicidad, FEVI descendida y cuando correspondiera, según el desarrollo de cardiotoxicidad durante el seguimiento.
Estudios de imagen
En todos los pacientes se realizó un ecocardiograma completo utilizando un equipo de ultrasonido (Vivid S6 General Electric) con monitoreo electrocardiográfico simultáneo en caso de realización de SLG, utilizando un transductor de 3,5 MHz, de acuerdo con las recomendaciones de la Sociedad Americana de Ecocardiografía17. Se midieron diámetros, volúmenes y FEVI mediante método de Simpson biplano en proyecciones apical de 4 y 2 cámaras, con 3 ciclos cardíacos consecutivos, la función diastólica se estimó mediante Doppler pulsado a nivel de la válvula mitral en el plano A4C y mediante la onda diastólica precoz del anillo mitral septal y lateral con Doppler tisular. El volumen de la AI se calculó mediante el método biplano área-longitud. Se evaluaron la anatomía y función valvulares y presencia de derrame pericárdico de acuerdo con las guías de práctica clínica. La obtención de SLG se hizo mediante técnica de Speckle Tracking, se obtuvo un loop de 4, 2 cámaras y 3 cámaras y determinando los valores de SL en cada uno de los 17 segmentos del VI, representados en un mapa polar (ojo de buey). El valor del SLG se calculó como el promedio de los SL pico obtenidos en todos los segmentos. Los valores de SLG varían según la edad, el sexo, las condiciones de carga y el software utilizado para su medida. Se define como normal un valor de -17% para hombres y -18% para mujeres, es significativo un cambio relativo de 15% en medidas sucesivas17. Los datos estructurales se obtuvieron a partir del ecocardiograma Doppler, incluyendo los valores de SLG, cuando estuvieran disponibles. Se realizó ecocardiograma previo al TPH y a los 3 meses de este, y en el momento que se requiriera, según evolución clínica.
Aspectos éticos
Se respetaron los principios de la declaración de Helsinki para experimentación en humanos. El proyecto fue aprobado por el Comité de Ética institucional e inscrito en la base de datos de investigaciones en humanos del Ministerio de Salud Pública. Esta investigación forma parte de un proyecto de tesis de maestría del Pro.In.Bio de naturaleza retrospectiva, que obtuvo los consentimientos informados de todos los pacientes en distintos momentos.
Estadística
La distribución normal de los datos se verificó mediante el test de Anderson-Darling. Los datos de las variables categóricas se presentan como frecuencias absolutas y relativas (%), mientras que las variables continuas se presentan por como medias ± desviaciones estándar o medianas ± rangos intercuartilicos (RIQ) 25-75%, según corresponda. Las variables categóricas se compararon mediante test exacto de Fisher con corrección de Yates. Las variables continuas medidas en toda la muestra durante los controles seriados se compararon con los valores basales obtenidos antes del TPH mediante ANOVA de medidas repetidas o test de Friedman, según corresponda. Las medidas de FEVI basal se compararon con las obtenidas a los 3 meses del TPH mediante prueba t pareada o test de Wilcoxon, cuando corresponda. Posteriormente, este se aplicó para diferentes subpoblaciones de pacientes con diferente perfil de riesgo CV: score de Tichelli, alteraciones del SLG basal, tipo de patología oncológica de base (leucemias vs. no leucemias) y diferentes regímenes de terapia QMT recibida previa al TPH. Se consideró como significativo un valor de p <0,05 (dos colas). Para los análisis y construcciones gráficas se utilizó el software GraphPad Prism (versión 9.0).
Resultados
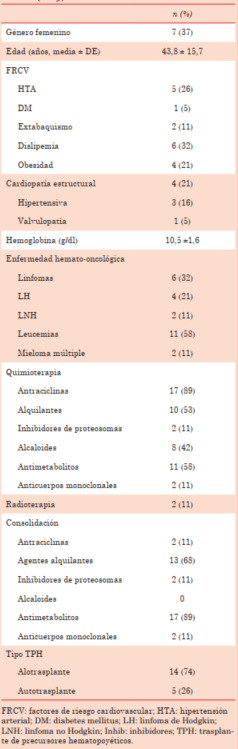
Las características basales clínicas y oncológicas de toda la población de estudio se resumen en la (tabla 2). Se incluyeron 19 pacientes, 37% mujeres, de 18 a 66 años. Cuatro pacientes (21%) presentaron un score de Tichelli de 1, equivalente a un riesgo CV elevado. Un total de 4 pacientes eran portadores de cardiopatía estructural; 3 de ellos presentaban cardiopatía hipertensiva definida por parámetros estructurales en el ecocardiograma, y un paciente presentaba valvulopatía crónica, era portador de prótesis mecánica mitral. Los sujetos incluidos recibieron diversos regímenes de QMT según indicación oncológica, las antraciclinas fueron las más utilizadas (89%). Previo al TPH, todos recibieron tratamiento de acondicionamiento de intensidad reducida con drogas QMT, el cual estuvo dirigido a lograr inmunosupresión para evitar el rechazo del injerto. El 89% recibió terapia de acondicioamiento con antimetabolitos y el 68% con agentes alquilantes (tabla 2).
En condiciones basales pretrasplante, la FEVI fue de 58,0 [52,0-60,0]% y el SLG del VI fue de -16,9 ± 4,6. No se detectaron cambios significativos de la FEVI a los 3 meses, 58,0 [52,0-60,0] vs. 58,0 [53,0-60,0]%, p = 0,82 (figura 1). Según criterios estructurales, un solo paciente presentó cardiotoxicidad, definida por un descenso de la FEVI > 10% y alcanzando un valor por debajo del límite inferior de la normalidad (53%). En cuanto al SLG, en dos casos se observó una reducción relativa mayor al 15% con respecto al SLG previo.
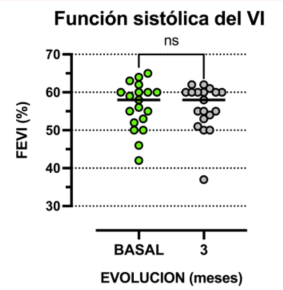
Figura 1: Valores evolutivos de la FEVI obtenidos por ecocardiograma Doppler luego del TPH. Test de Wilcoxon, valores expresados en medianas.
No se observó aumento de la TnI en ningún caso. La concentración sérica de BNP, en cambio, se elevó desde valores basales de 13,6 [6,1-30,9] pg/ml a 38,9 [16,3-120,0] pg/ml al primer mes y 28,9 [0,04-123,2] pg/ml a los 3 meses (p = 0,036 basal vs. 1 mes, p = 0,39 basal vs. 3 meses) (figura 2).
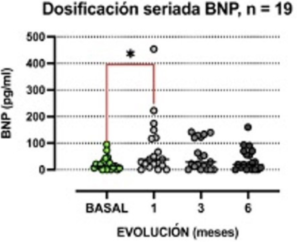
Figura 2: Cambios evolutivos de los valores de BNP séricos en los controles seriados de toda la muestra. Test de Friedman, valores expresados en medianas. * p < 0,05.
No se observó una asociación consistente entre el aumento del BNP al mes en relación con el género (figura 3). La edad tampoco se asoció con los niveles séricos de BNP: 23,2 ± 57,5 pg/ml en sujetos de 40 años o menos y de 49,4 ± 127,0 pg/ml en mayores a 40 años (p = 0,17).
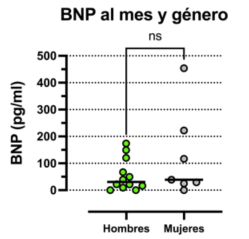
Figura 3: Valores séricos de BNP al mes en sujetos de distinto género. Test de Mann-Whitney, valores expresados en medianas.
La elevación de BNP no se asoció con el riesgo CV estimado por el score de Tichelli (score de 0: 0,29 ± 110,6 pg/ml vs. score de 1: 44,5 ± 101,9 pg/ml, p = 0,73). Se detectaron diferencias significativas en la liberación de BNP al primer mes post-TPH en la subpoblación de pacientes portadores de leucemia (p = 0,039, panel A de la (figura 4), probablemente relacionado con el tratamiento, tipo y dosis de planes recibidos. Por último, se analizó la liberación de BNP en relación con los distintos regímenes QMT y acondicionamiento recibido. Se detectó una mayor elevación de dicho marcador al mes en aquellos que recibieron antimetabolitos como tratamiento QMT previo (BNP basal: 13,6 ± 24,8 pg/ml vs. BNP al mes: 67,0 ± 152,7 pg/ml, p = 0,039). No encontramos diferencias en la liberación de BNP precoz (al mes) en relación con los QMT utilizados, esto es, en los subgrupos de pacientes que recibieron antraciclinas, alquilantes o alcaloides (figura 4).
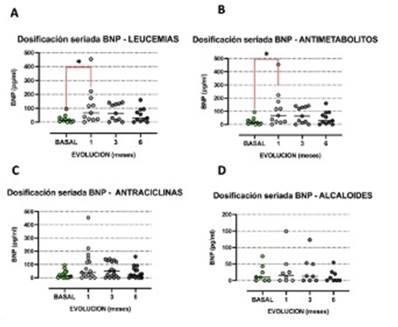
Figura 4: Análisis de subgrupos. Dosificación de BNP en controles sucesivos correspondientes a los subgrupos con leucemias (A) y terapias con antimetabolitos (B), antraciclinas (C) y alcaloides (D). Test de Friedman, valores expresados en medianas *p < 0,05.
En la (figura 5) se ilustran dos ejemplos de pacientes del estudio con diferente perfil de liberación de biomarcadores.
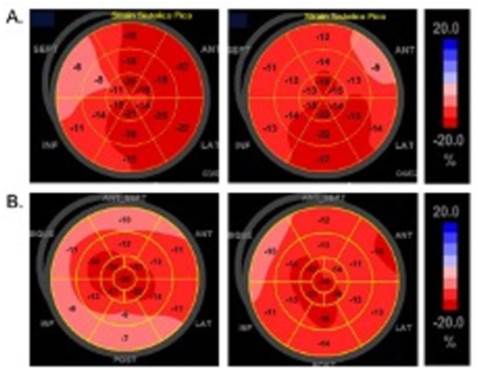
Figura 5: Ejemplos de toxicidad subclínica post-TPH en dos pacientes de nuestra serie. Se ilustran los resultados del SLG en dos pacientes, previo al TPH y al mes de este. Panel A: mujer de 29 años, sin factores de riesgo CV previos, portadora de leucemia aguda mieloblástica (LAM) que recibió QMT con antraciclinas y antimetabolitos. Se somete a TPH con plan de consolidación con antimetabolitos. En control inicial BNP: 95 pg/ml, FEVI: 50% y SLG: -16,1. A los 3 meses: dosificación de BNP: 133 pg/ml, FEVI: 45% y SLG: -14,8. Panel B: mujer de 45 años, obesa y dislipémica, portadora de LAM que recibió antraciclinas y antimetabolitos, seguida de una nueva serie de antimetabolitos en la consolidación. De la valoración inicial destacaba BNP: 13,6 pg/ml, que llega a valores máximos de 454 pg/ml al mes postrasplante. Los valores de FEVI y SLG se mantuvieron sin cambios en el control evolutivo a los 3 meses (FEVI: 50% y 53%, SLG: -15,7 y -13,0, respectivamente).
Discusión
El aumento significativo del BNP tras el TPH en nuestra población de estudio es consistente y confirma el desarrollo de cardiotoxicidad subclínica en un porcentaje considerable de pacientes sometidos a TPH (32%), alcanzando un pico máximo de liberación al mes postrasplante. Los reportes que han caracterizado esta cardiotoxicidad subclínica bioquímica en los pacientes que reciben TPH son muy escasos. Varios estudios observacionales han detectado la presencia de cardiotoxicidad por criterios funcionales habituales (descenso de la FEVI), con una incidencia que se acerca al 10% en algunas series. Esta cifra es aún mayor en sujetos con disfunción sistólica previa, lo que conlleva un mayor riesgo de mortalidad en el primer año posprocedimiento, principalmente en aquellos que presentaron algún evento CV28,29. La cardiotoxicidad subaguda ha sido inesperadamente común en algunas series, ocurre principalmente en el primer mes luego del trasplante, y es generalmente reversible29-33. Varias investigaciones longitudinales apoyan la importancia del control regular de la FEVI para predecir el riesgo CV y la cardiotoxicidad. Sin embargo, los pacientes con FEVI moderadamente disminuida pueden someterse a TPH y, a su vez, un valor alterado aislado de FEVI no suele correlacionarse estrechamente con el desarrollo de cardiotoxicidad27,29,30).
Si bien el SLG podría ser considerado como un parámetro subclínico de cardiotoxicidad que ha demostrado un mejor valor predictivo para mortalidad que la FEVI, este parámetro funcional no se obtuvo en todos los ecocardiogramas de nuestros pacientes. Se requiere ampliar la experiencia para definir el valor adicional de este parámetro como marcador de toxicidad subclínica en aquellos que reciben TPH. Aunque el papel de los biomarcadores BNP y TnI para predecir el riesgo CV está bien definido en algunas subpoblaciones de pacientes oncológicos, su valor como marcadores de cardiotoxicidad subclínica tras el TPH es aún controversial. Algunas experiencias han demostrado que los niveles de BNP aumentan en respuesta al incremento en la tensión parietal ventricular luego del TPH y predicen el desarrollo de cardiotoxicidad, por lo que podrían ser útiles durante el seguimiento31,32. T. Chung y col. estudió prospectivamente 32 pacientes sometidos a TPH, con seguimiento por 6 semanas. Los autores encontraron una mayor elevación precoz del BNP, esto es, en las 2-4 semanas posteriores al trasplante, siendo predictivo de toxicidad cardíaca inducida por QMT. El BNP aumenta en respuesta al estiramiento de la pared del VI secundario a diversas condiciones fisiológicas, se observa un aumento adaptativo normal en respuesta al incremento de las demandas miocárdicas. Sin embargo, en esta experiencia, la elevación del BNP también estuvo asociada con el desarrollo de IC clínica. En dicho estudio se observó un hallazgo inesperado: la elevación de BNP precoz como potencial factor “protector” para cardiotoxicidad, en contraposición con una elevación más tardía del BNP en los pacientes que desarrollaron cardiotoxicidad28. Las bases fisiopatológicas de este hallazgo se desconocen. La liberación máxima de BNP precoz tras el TPH podría ser secundaria a un aumento de la tensión parietal relacionada con la sobrecarga de volumen más que a la propia cardiotoxicidad relacionada con el tratamiento. Incluso, no está claro si el aumento sostenido de BNP es un predictor fiel para el desarrollo de una futura cardiotoxicidad definida por criterios de imagen. En efecto, se ha encontrado una escasa correlación entre el BNP y los cambios de la FEVI tras la QMT, con un escaso descenso a las 6 semanas31,33-35. Dado que no contamos con ETT hasta los 3 meses postrasplante, no podemos contrastar nuestros hallazgos con los obtenidos en dicho estudio.
En el plano local, Oliver y col. realizaron un análisis prospectivo de los cambios bioquímicos y ecocardiográficos durante el TPH, encontraron que los valores de pro-BNP aumentan durante el trasplante, y se mantienen elevados al día 30 en el 53% de los casos. En relación con el SLG, se observó una reducción significativa en el 12,5% de los pacientes. Los autores concluyen que estos cambios podrían ser predictivos de cardiotoxicidad clínica36.
No detectamos elevación sérica de TnI en ninguno de nuestros pacientes durante los controles sucesivos. Las experiencias previas han demostrado que las troponinas son marcadores específicos, pero poco sensibles de toxicidad cardíaca, con mayores niveles en los controles al primer mes o posteriores, mayor tras la QMT en dosis altas. Estos cambios suelen mostrar una correlación estrecha con el deterioro de la FEVI. Dado que no contamos con seguimiento imagenológico al mes en todos los pacientes de nuestra serie, esto es, durante el pico máximo de elevación de los biomarcadores, no disponemos de datos empíricos para contrastar con lo descrito en la literatura33,35.
Aún con las limitaciones inherentes al pequeño tamaño muestral, los resultados de nuestro análisis de subpoblaciones sugieren que el daño miocárdico podría depender de los regímenes de QMT previa y acondicionamiento (figura 4). Clásicamente, el fenómeno de la cardiotoxicidad es dependiente de las dosis de QMT, más comúnmente de las antraciclinas. Sin embargo, en el estudio de E. Cardinale y col. no se observó esta correlación, por lo que la ausencia de antraciclinas como agentes QMT previos al TPH no excluye el desarrollo de disfunción sistólica significativa tras la terapia de acondicionamiento29. Debido a la conocida cardiotoxicidad relacionada con estos agentes, analizamos especialmente la relación entre su administración y el perfil de biomarcadores en nuestra población. Destacamos que la mayoría de los pacientes incluidos con leucemia o linfoma recibieron antraciclinas. Sin embargo, el análisis de subgrupos no demostró una correlación independiente entre la exposición a las antraciclinas y la liberación de BNP. En contraposición, los sujetos sometidos a terapia previa con antimetabolitos presentaron una mayor elevación de BNP.
La influencia de la QMT acondicionadora sobre la estructura y función miocárdicas es multifactorial y compleja. Además, no debe perderse de vista que el TPH está precedido por regímenes de acondicionamiento que, por su nivel de intensidad, se pueden clasificar en mieloablativos, donde se compromete totalmente la médula ósea, y no mieloablativos, que, aunque acarrean una toxicidad reducida, suelen utilizar esquemas de acondicionamiento con agentes alquilantes en dosis elevadas30.
Existe amplio consenso sobre que la detección temprana de la cardiotoxicidad es la mejor práctica para prevenir el desarrollo de disfunción sistólica posterior a la terapia onco-específica. Un nuevo enfoque que haga hincapié en la detección precoz del daño subclínico, con base en la medición de diversos biomarcadores séricos y parámetros funcionales y estructurales obtenidos por técnicas de imagen puede proveer una batería de herramientas útiles, de bajo coste y fácil interpretación, a la hora de identificar los pacientes más susceptibles para el desarrollo de cardiotoxicidad post-TPH. Para esto se requiere cuantificar la relación de la liberación de los biomarcadores miocárdicos con determinados planes de acondicionamiento y definir la capacidad de los nuevos parámetros para predecir la toxicidad cardiovascular postrasplante antes de que sobrevenga la temida disfunción sistólica. Además de su valor como casuística local, creemos que nuestros hallazgos preliminares generan hipótesis interesantes a la hora de afrontar estos desafíos clínicos.
Asumimos que nuestro estudio presenta ciertas limitaciones. La principal limitante radica en el número reducido de pacientes derivados a un solo centro de referencia, lo que representa una pequeña proporción de los pacientes oncológicos que reciben QMT. Además, los pacientes fueron seguidos a corto plazo. Se requiere ampliar nuestra serie para agregar mayor potencia estadística a los resultados obtenidos, e incluso avanzar con un enfoque multivariado que permita definir potenciales confusores. Subrayamos aquí que los individuos con enfermedades hemato-oncológicas con indicación de TPH integran un subgrupo particular, con especificidades terapéuticas y riesgo CV diferente a otras subpoblaciones. Debido al bajo número de pacientes que desarrollaron cardiotoxicidad por criterios clásicos, no pudo evaluarse la correlación entre los valores de biomarcadores y el desarrollo de disfunción sistólica. Se incluyeron pacientes con diferentes enfermedades y regímenes QMT, que pueden reducir el poder del estudio para identificar toxicidad relacionada al tratamiento. Tampoco se analizaron otros parámetros de importancia en el desarrollo de cardiotoxicidad (función renal, dosis de los regímenes QMT, índices de sobrecarga de hierro y perfil lipídico, entre otros) ni se obtuvieron medidas sucesivas estructurales completas en todos los casos. Finalmente, no puede excluirse la influencia de un sesgo de referencia asociado a la exclusión de pacientes portadores de cardiopatías estructurales avanzadas y riesgo CV pretrasplante elevado.
Conclusiones y perspectivas
En nuestro centro, la liberación de BNP posterior al TPH es un evento frecuente (32% de los pacientes), alcanzando un máximo precoz al mes postrasplante, independientemente del valor de la FEVI basal. Este perfil bioquímico no difiere mayormente en relación con diversas variables clínicas y estructurales. Los pacientes que recibieron antimetabolitos exhiben una mayor liberación precoz de BNP. Se requiere ampliar la serie y prolongar el seguimiento para definir la utilidad clínica independiente de los controles bioquímicos seriados asociados a otros hallazgos estructurales en los candidatos a TPH que son sometidos a diferentes regímenes de QMT previa y acondicionadora.