Introducción
Babesia (Piroplasmida: Babesiidae) es un género de protozoos apicomplexa transmitidos por garrapatas que parasitan los eritrocitos en huéspedes vertebrados (Mehlhorn y Schein, 1985; Pinazo et al., 2017). Varias especies de Babesia parasitan a los perros y causan la enfermedad conocida como babesiosis canina, Babesia spp. se multiplica dentro de los eritrocitos y causa su lisis y los subsiguientes síntomas de anemia hemolítica, como membranas mucosas pálidas y petequias, apatía y letargo, fiebre, anorexia, hipotensión, hemoglobinuria y uremia, taquicardia, isquemia, signos neurológicos centrales y coma. En algunos casos, puede llevar a la muerte del animal (Saari et al., 2018). La variación en la gravedad del caso depende del estado inmunológico del animal, pero también de la especie y cepa de Babesia spp. involucrada.
Babesia gibsoni y Babesia microti pueden clasificarse como babesias pequeñas, miden menos de 2 μm de diámetro; mientras que Babesia canis, Babesia rossi y Babesia vogeli son babesias grandes, con más de 3 μm de diámetro (Saari et al., 2018). En el pasado, todas las babesias grandes se consideraban primero como B. canis y luego como subespecies de B. canis, debido a su morfología similar (Solano-Gallego y Baneth, 2011). Hoy en día, con el avance de la biología molecular, se sabe que estas son tres especies diferentes (Carret et al., 1999) que tienen una mayor distinción en términos de los signos clínicos que generan, su especificidad de vectores y distribución geográfica (Uilenberg et al., 1989).
Rhipicephalus sanguineus y B. vogeli siempre han estado asociados con perros domésticos; se presume que, por esta razón, es la especie menos virulenta de Babesia y causa síntomas leves, como anemia en cachorros o infecciones asintomáticas en adultos (Köster et al., 2015). A pesar de que B. vogeli es la especie que genera los síntomas menos graves, es la especie más ampliamente distribuida y cosmopolita (Penzhorn, 2020). Existen varios informes en América, como Argentina, Brasil, Chile, Colombia, Costa Rica, Paraguay, Perú, Venezuela, México, Granada, Haití, Nicaragua y Trinidad y Tobago (Panti-May y Rodríguez-Vivas, 2020). Esta distribución geográfica está vinculada al único vector biológico confirmado, R. sanguineus.
Uruguay, ubicado en la región sudeste de América del Sur, entre Argentina, Brasil y el océano Atlántico, es un país que se encuentra completamente dentro de la zona templada y tiene un clima subtropical húmedo, lo que favorece la presencia y permanencia de múltiples parásitos y sus vectores. Uruguay ha confirmado cinco especies que parasitan a los perros, a saber, Amblyomma aureolatum, Amblyomma tigrinum, Amblyomma triste, R. sanguineus y, ocasionalmente, Rhipicephalus microplus (Nava et al., 2017). Entre estas garrapatas, A. aureolatum y R. sanguineus se destacan por ser vectores de patógenos importantes. Amblyomma aureolatum transmite Rangelia vitalii, un hemoparásito, que fue descrito por primera vez en Uruguay en 1976 (Sarasúa y Ponati, 1976) y del cual existen numerosos informes de casos. Rhipicephalus sanguineus también es un vector muy importante que transmite Hepatozoon canis y Anaplasma platys (Dantas-Torres y Otranto, 2015; Rivero et al., 2017). A pesar de que R. sanguineus está ampliamente distribuido en Uruguay, no hubo confirmación de B. vogeli hasta el año 2024 (Parodi et al.2024). Este estudio tiene como objetivo reportar un caso de babesiosis por B. vogeli y su confirmación molecular en un perro de Uruguay.
Materiales y métodos
En octubre de 2023, una perra mestiza, de unos 4 meses de edad, fue encontrada deambulando en la zona de Villa García, Montevideo, Uruguay (34°46'52"S y 56°3'12"O). La perra se encontraba en malas condiciones y con una ligera depresión en su función sensorial. Fue llevada al Hospital Veterinario de la Facultad de Veterinaria, Universidad de la República. Durante el examen clínico se observaron apatía, pelaje hirsuto, sialorrea, mucosa oral pálida y fiebre leve (figura 1). Además, se observó una infestación severa de garrapatas y los ganglios linfáticos submandibulares y preescapulares agrandados.
Se recuperaron doce garrapatas para su identificación morfológica, se tomaron muestras de sangre entera y suero (tubos con EDTA). Se prepararon frotis sanguíneos que se secaron al aire, se fijaron con metanol y, para la tinción, se realizó Giemsa. Para su observación al microscopio (Olympus CX41), se usó el objetivo de inmersión. Las garrapatas se identificaron morfológicamente hasta el nivel de especie utilizando un microscopio estereoscópico y una clave taxonómica (Nava et al., 2017). Con la muestra de sangre entera restante, se realizó hemograma y extracción de ADN.
Posteriormente, se extrajo el ADN de las garrapatas. El ADN de la sangre y de las garrapatas se extrajo utilizando el DNeasy Blood y Tissue Kit (Qiagen, Hilden, Alemania) siguiendo las instrucciones del fabricante. La concentración de ADN se estimó utilizando un NanoDrop One/One (ThermoFisher Scientific, Lituania). Se realizó una PCR para la detección de un fragmento del gen de ARN ribosomal de la pequeña subunidad de las familias Babesiidae y Theileriidae siguiendo el protocolo de Soares et al. (2011). Junto con las muestras, se incluyeron controles positivos y negativos de Theileria equi y agua libre de ADN, respectivamente. Los amplicones de tamaño esperado fueron enviados a MacroGen Corea (https://dna.macrogen.com/) para su secuenciación.
Resultados
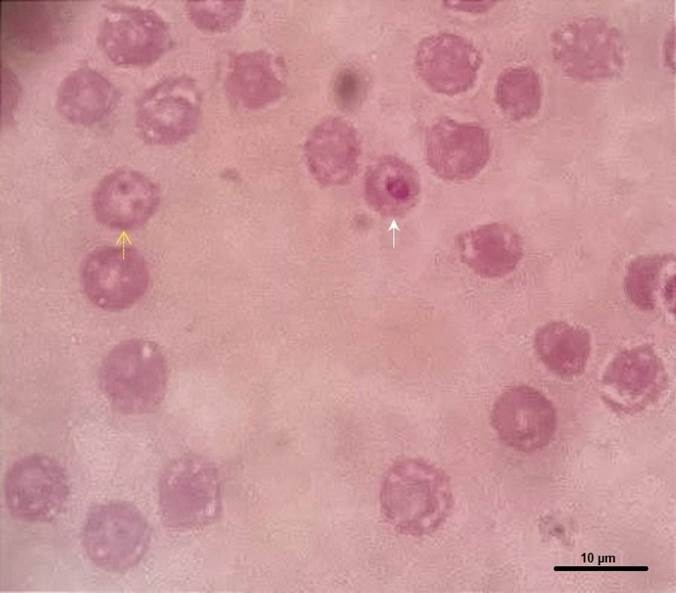
Se encontraron algunos parámetros alterados en el hemograma, a saber: hematocrito 22,5 %, linfocitosis y neutropenia, trombocitopenia, aumento de la amplitud de distribución eritrocitaria (RDW) y un ligero incremento en los reticulocitos (tabla 1). Un frotis sanguíneo reveló dos eritrocitos parasitados, en uno se observó el típico par de formas piriformes grandes de Babesia (figura 2, flecha amarilla) y en el otro la forma anular única (figura 2, flecha blanca).
A pesar de que se realizaron más extensiones de frotis, solo se observaron parasitados los eritrocitos fotografiados en la figura 2. De las garrapatas colectadas, siete eran R. sanguineus, cuatro hembras y tres machos (figura 3), y cinco eran A. triste, dos machos y tres hembras (figura 4).
Tabla 1: Resultados de bioquímica sanguínea de la paciente

Observaciones: Linfocitos reactivos. Recuento de plaquetas estimado por lámina entre 45000 y 60000 plaquetas/µ
La PCR confirmó la presencia de ADN de Babesia spp. en la muestra de sangre, sin embargo, todas las garrapatas fueron negativas. La secuencia obtenida resultó 100 % idéntica a una secuencia de B. vogeli de Buenos Aires, Argentina (número de acceso KY290976). La secuencia se registró en GenBank bajo el número de acceso PP373120.
Después de la confirmación molecular de B. vogeli, se administró tratamiento específico con imidocarb dipropionato a 7,5 mg/kg (Köster et al., 2015) al perro. Al cabo de tres meses, el perro regresó al Hospital Veterinario y se confirmó como clínicamente sano.
Discusión
Durante el curso de una babesiosis canina, se produce la destrucción de los eritrocitos parasitados que desencadena, como signo principal, anemia hemolítica (Saari et al., 2018). El hemograma de la paciente mostró parámetros típicos de una infección por Babesia spp., con una anemia hemolítica evidenciada por un eritrocitario de 3,47 mill/ul y hemoglobinemia de 7,3 g/dl. Asimismo, se constató una marcada trombocitopenia (7000 plaquetas/ul). En el frotis sanguíneo, solo se detectaron dos eritrocitos parasitados. Esto podría indicar una baja carga parasitaria en el momento del muestreo, lo que subraya la limitación de la microscopía para el diagnóstico de babesiosis, especialmente en infecciones leves o crónicas. A su vez, Mosqueda et al. (2012) señalan que la técnica del frotis sanguíneo necesita de operarios experimentados y solo puede ser diagnosticada en infecciones agudas con alta parasitemia, por lo que la mayoría de los casos requieren confirmación molecular, como fue el caso en este estudio.
El hecho de que las garrapatas colectadas no presentaran ADN de Babesia spp. podría explicarse por varios factores. En primer lugar, la transmisión de B. vogeli puede no haber ocurrido a través de las garrapatas colectadas, ya sea porque la perra haya sido infectada previamente con otras garrapatas o porque la transmisión transestadial en R. sanguineus depende de múltiples factores, como la etapa de desarrollo de la garrapata y el tiempo de alimentación sobre el hospedador infectado (Dantas-Torres, 2010). En segundo lugar, si bien R. sanguineus es el vector biológico conocido de B. vogeli, es sabido que dentro de una población de estas garrapatas el porcentaje de individuos realmente infectados es muy bajo (Chao et al., 2016; Navarrete et at., 2016). En Uruguay, este vector tiene una amplia distribución, lo que sugiere que la babesiosis podría estar subdiagnosticada debido a que los signos son inespecíficos y a la falta de confirmación molecular rutinaria en la práctica clínica veterinaria.
El hecho de que la secuencia de ADN de B. vogeli obtenida en este estudio sea 100 % idéntica a una secuencia registrada en Buenos Aires, Argentina (KY290976), resalta la posible continuidad geográfica de esta especie en la región. Argentina y Uruguay comparten características climáticas y ecológicas similares que pueden favorecer la presencia de garrapatas y la transmisión de patógenos de interés médico y veterinario en la región. Esta similitud geográfica sugiere que podrían existir más casos de B. vogeli en Uruguay que aún no han sido detectados. En particular, en Uruguay, solo existen dos reportes de Babesia spp. Fumagalli et al. (2013) reportan un caso diagnosticado por frotis de Babesia canis, sin confirmación molecular. Más recientemente, Parodi et al. (2024) reportan cuatro muestras molecularmente positivas a B. vogeli de perros del sur del país. El desconocimiento de la distribución de este parásito justifica la realización de estudios epidemiológicos más amplios en el país.
En términos de diagnóstico, este caso destaca la necesidad de combinar técnicas tradicionales, como el frotis sanguíneo y el hemograma, con métodos moleculares más sensibles, como la PCR. El diagnóstico preciso de babesiosis es fundamental, ya que el tratamiento específico con imidocarb dipropionato es necesario para la resolución del cuadro clínico. En este caso, la rápida administración de este fármaco llevó a la recuperación completa de la paciente, el cuadro también se confirmó mediante el diagnóstico terapéutico. Lo mencionado antes refuerza la importancia de un diagnóstico y tratamiento tempranos para evitar complicaciones graves.
Por último, este estudio tiene implicaciones importantes para la medicina veterinaria en Uruguay. Si bien B. vogeli no es considerado altamente patógeno en comparación con otras especies de Babesia, su amplia distribución y la presencia de su vector en áreas urbanas y rurales hacen que sea necesario aumentar la vigilancia epidemiológica. Además, este caso subraya la importancia de incluir la babesiosis en los diagnósticos diferenciales de perros con signos clínicos de anemia hemolítica, en especial en cachorros, animales inmunocomprometidos, así como rescatados de situaciones de vulnerabilidad, como es el caso presentado.
Conclusiones
Los resultados obtenidos en este estudio son de suma importancia para la medicina veterinaria de nuestro país, ya que describen por primera vez un caso autóctono de Babesia vogeli en una perra y su confirmación molecular. Este hallazgo amplía el conocimiento sobre la distribución geográfica de B. vogeli en América Latina y destaca la necesidad de considerar esta especie en el diagnóstico diferencial de enfermedades transmitidas por garrapatas en perros.