Caso clínico 1
Madre 22 años, procedente de Rivera. Se realiza diagnóstico ecográfico prenatal de gastrosquisis a las 13 semanas. Culminación del embarazo por cesárea de urgencia por sufrimiento fetal agudo. Nace una paciente de sexo femenino, pretérmino de 34 semanas, bajo peso al nacer de 2.320g, vigorosa. Al examen se constata diagnóstico de gastrosquisis compleja por presentar además atresia yeyunal, con clava alta a 35 cm de ángulo de Treitz, y necrosis de yeyuno distal, íleon y colon ascendente. En la cirugía, a las 15 horas de vida, se realiza resección de sector necrótico, yeyunostomía desfuncionalizante, y fístula mucosa distal en colon transverso. La medición de la longitud del intestino remanente es de 35 cm de yeyuno, seguidos de colon trasverso, descendente y sigmoides.
A los 4 meses, dado alto gasto por yeyunostomía (promedio de 55cc/kg/día), se reconstruye el tránsito mediante anastomosis yeyuno colónica término terminal.
A las 2 semanas se reinterviene por cuadro suboclusivo, constatándose angulación a nivel de la anastomosis, y dilatación intestinal proximal; se realiza remodelación con máquina de sutura lineal cortante en sentido longitudinal.
A los 8 meses de vida, continúa con requerimientos de nutrición parenteral, peso estacionario, y cuadros suboclusivos reiterados, por lo que se decide realizar exploración quirúrgica y procedimiento de elongación intestinal con técnica de Bianchi.
Del procedimiento, se mide longitud intestinal (desde Treitz a anastomosis yeyuno colónica previa) constatándose un crecimiento espontáneo a 57 cm. Se selecciona sector de 17 cm de yeyuno dilatado (4,5 cm de diámetro), y se divide de éste en sentido longitudinal para conformar dos hemiasas, primero en su borde antimesentérico, y luego mesentérico, utilizando electrocauterio bipolar. Las hemiasas se construyen plegando cada mitad sobre sí misma en el eje longitudinal, y suturando sus bordes. La sutura se realiza de forma manual, en monoplano con hilo reabsorbible multifilamento 4-0. Luego se restablece la continuidad intestinal anastomosando los tres sectores en forma isoperistáltica (yeyuno con primer hemiasa, hemiasas entre sí, y segunda hemiasa con colon). La longitud intestinal final es de 74 cm.
Durante el procedimiento quirúrgico se cuenta con la asistencia remota a través de videollamada del Dr. Bianchi, cirujano pediátrico del Royal Manchester Children’s Hospital de Inglaterra, creador de la técnica, que permite la supervisión y asesoramiento en tiempo real en los detalles técnicos. (Fig.1) muestra fotos intraoperatorias del procedimiento.
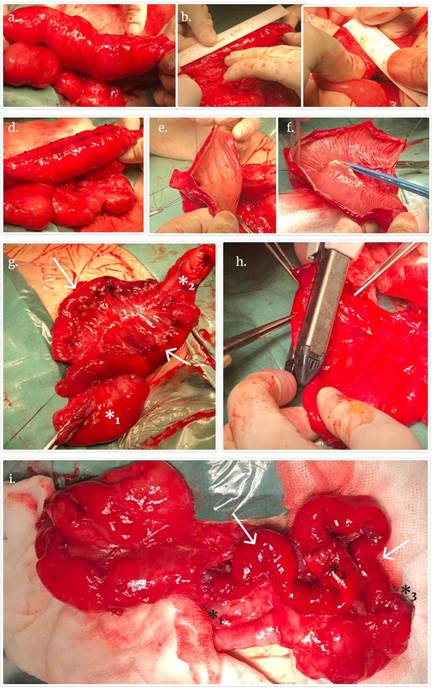
Fig.1 Técnica de Bianchi. a-c) Selección de asa midiendo longitud y diámetro. d y e) División longitudinal del borde antimesentérico, previa colocación de puntos tractores a ambos lados de la línea media, separados por 2 cm; queda expuesta la mucosa intestinal. f) División del borde mesentérico con electrocauterio bipolar. g) Ambas hemiasas confeccionadas (flechas), yeyuno dilatado (asterisco 1) y colon (asterisco 2). h) Remodelación yeyunal con máquina de sutura lineal cortante. i) Resultado final, ambas hemiasas (flechas), anastomosis proximal (asterisco 1), anastomosis entre ambas hemiasas (asterisco 2), y anastomosis distal (asterisco 3). Fuente: autores
En el postoperatorio la paciente evoluciona sin complicaciones, comienza con deposiciones al cuarto día, e inicia aporte enteral al séptimo.
En la (Fig.2) se observa la comparación entre radiografías simples de abdomen del pre y postoperatorio, nótese la diferencia en el calibre de las asas.
En los siguientes 4 meses postoperatorios, se logra ganancia de 3 Kg, decidiendo alta con nutrición parenteral domiciliaria al año de vida, y suspendiéndose ésta última al año y 5 meses.
A los 3 años de seguimiento, presenta un peso de 15 Kg, se encuentra asintomática y de alta desde punto de vista quirúrgico y nutricional.
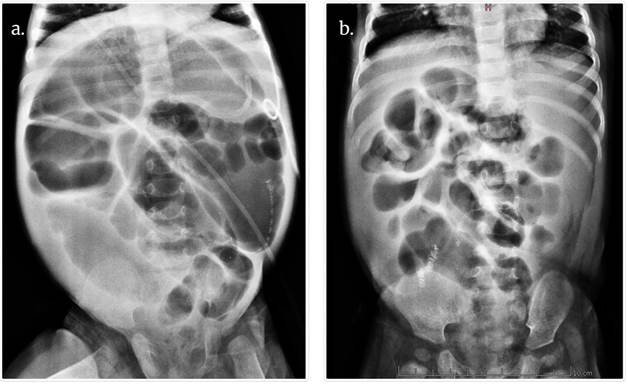
Fig.2 Radiografías simples de abdomen. a) Radiografía preoperatoria de procedimiento de Bianchi, gran dilatación de asas yeyunales; colon de menor calibre sin su posición anatómica normal dado su condición previa de malrotación por su gastrosquisis. b) Postoperatorio de Bianchi, nótese la disminución franca de diámetro de asas luego de la cirugía. Fuente: autores
Caso clínico 2
Madre 24 años procedente de Fray Bentos, consumidora de drogas psicoactivas. Diagnóstico prenatal de gastrosquisis a las 13 semanas; rotura prematura de membranas, cesárea de urgencia por sufrimiento fetal agudo. Recién nacido de sexo femenino, pretérmino de 36 semanas, peso al nacer 2.738 g, vigorosa. En la recepción se constata gastrosquisis compleja con atresia intestinal tipo “apple peel”, clava yeyunal a 40 cm de ángulo de Treitz. A las 6 horas de vida, se realiza cirugía que constata remanente intestinal de 40 cm de yeyuno, sumado a colon transverso, descendente y sigmomides; se decide yeyunostomía desfuncionalizante y fístula mucosa distal en colon transverso. A los 30 días de vida se reinterviene para realiza yeyunostomía funcionalizante tipo Santulli quedando anastomosis intraabdominal yeyuno colónica termino lateral.
A los 5 meses se realiza cierre de yeyunostomía.
En la evolución, continúa con fallo nutricional pesando al año y 6 meses 9 Kg, y varios episodios de traslocación bacteriana intestinal y sepsis por catéter, con dependencia de alimentación parenteral, por lo que se decide realizar procedimiento de elongación intestinal con técnica de Bianchi.
Se constata en la cirugía una longitud de 55 cm de yeyuno, de los que se seleccionan 35 cm dilatados con un diámetro de 5 cm (Fig.3). Se realiza elongación con misma técnica que caso clínico 1, logrando longitud intestinal final de 90 cm.
En el postoperatorio presenta buena evolución, sin complicaciones, con reinicio de vía oral al sexto día, logrando a los 5 meses aumento de 4 Kg y suspensión total de nutrición parenteral, por lo que se otorga alta a domicilio.
Actualmente tiene 3 años y 6 meses, pesa de 15.3 Kg, se encuentra asintomática, no ha requerido nuevos ingresos hospitalarios, y continúa con control gastroenterológico.
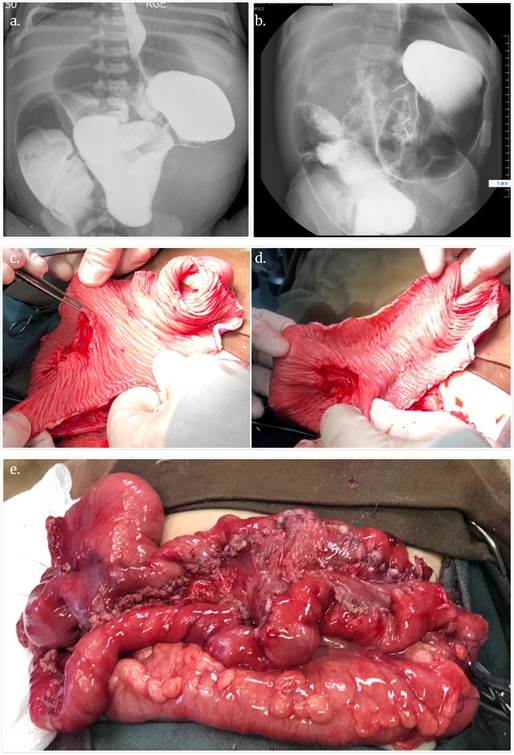
Fig.3 a y b) Estudio contrastado de intestino delgado que muestra marcada dilatación yeyunal prepoperatoria. c y d) Foto intraoperatoria del asa elegida para elongación, ya abierta por su borde antimesentérico, visualizándose la mucosa intestinal, y realizando apertura del borde mesentérico. e) Resultado final. Fuente autores
Discusión
La falla intestinal se define como la reducción de la función intestinal por debajo del mínimo necesario para asegurar la digestión y absorción de macronutrientes, agua y electrolitos, requiriendo nutrición parenteral para mantener el estado de salud y crecimiento. 1,2 Dentro de sus causas se encuentran el síndrome de intestino corto (SIC), principal causa1 ; los trastornos de motilidad (displasias neuronales intestinales); la enfermedad del parénquima intestinal (dentro de las que se incluyen la Enfermedad Crohn); y la fístula intestinal.3
El SIC se define como la disminución de la longitud intestinal, que conlleva a la mal absorción y falla intestinal.1) La cantidad requerida en centímetros no está bien definida en niños, pero según la literatura internacional, se requiere una longitud residual mayor de 25% de la esperada para la edad gestacional para mantener la autonomía enteral; por lo tanto, por debajo de dicho valor, estaríamos frente a un SIC.1 Según Strujus et al,4 la media de longitud del intestino delgado desde el ángulo de Treitz hasta la válvula ileocecalvaría según la edad, siendo de: 70 cm (( 6.3) en pretérminos de 24 a 26 semanas de edad gestacional;157.4 (( 11.2) en términos de 39 a 40 semanas; 239.2 (( 18.3) en lactantes de hasta 6 meses; y de 423.9 cm (( 5.9) en niños de entre 4 y 5 años. En cirugías que requieran resecciones intestinales mayores, la medición intestinal es de suma importancia, ya que constituye uno de los principales factores pronósticos y predictivos de rehabilitación intestinal.4
Las causas de SIC pueden ser congénitas como atresias intestinales y gastrosquisis complejas; o adquiridas, como vólvulo de intestino medio, o enterocolitis necrotizante.5
El SIC se clasifica en tres tipos: I, II y III. El tipo I es el de peor pronóstico, caracterizándose por resección yeyunoileal y del colon completo, y yeyunostomía terminal. El tipo II, el más frecuente, implica la resección yeyunoileal pero con colon intacto o parcialmente comprometido, careciendo de válvula ileocecal, y con intestino en continuidad por anastomosis yeyunocolónica. El tipo III, es el de mejor pronóstico, con resección predominantemente yeyunal, presencia de al menos 10 cm de íleon, anastomosis yeyunoileal y presencia de válvula ileocecal.2
La evolución del SIC presenta tres etapas: aguda, adaptación y mantenimiento. La aguda ocurre durante las 3 - 4 semanas luego de la resección intestinal, caracterizada por deshidratación y disionías. La adaptación conlleva 1 - 2 años, y consiste en el aumento de la superficie absortiva tanto a nivel estructural como funcional.6,7) En lo estructural macroscópico ocurre la dilatación intestinal,mientras que en lo microscópico el aumento de número de vellosidades y profundidad de criptas; y en lo funcional se produce el enlentecimiento del tránsito intestinal. La última etapa de mantenimiento, se caracteriza por persistencia de falla intestinal, donde la única alternativa son la nutrición parenteral domiciliaria, o el transplante intestinal.1
En las últimas dos décadas han mejorado los resultados, con sobrevidas de más del 90%, gracias al abordaje multidisciplinario especializado,8 y mejoras tanto en el tratamiento médico (nutrición parenteral domiciliaria, análogos de GLP-2); como en el quirúrgico, con la cirugía de reconstitución autóloga gastrointestinal (CRAGI), y el trasplante intestinal. La indicación quirúrgica se impone cuando falla el tratamiento médico, una vez completada la fase de adaptación, y obtenida una dilatación intestinal aceptable como veremos.5
La CRAGI entre otras, incluye las técnicas de elongación intestinal,6 siendo las más frecuentes: las longitudinales o LILT (longitudinal intestinal lengthening and tailoring), comúnmente llamado procedimiento de Bianchi, descripto por primera vez por Adrian Bianchi en 1980;9,10 las transversales o STEP (serial transverse enteroplasty) propuesta por Kim et al en 2003,11 y las espirales o SILT (spiral intestinal lengthening and tailoring) más recientemente creada en 2011 por Cserni et al.12
El fundamento del éxito de estas técnicas es además de elongar el intestino, hacerlo más estrecho, hasta un diámetro final aceptado de hasta 2 cm.9-16 De esta manera mejora la peristalsis anterógrada, elimina la estasis y el sobrecrecimiento bacteriano.
El procedimiento de Bianchi consiste en aislar un segmento intestinal dilatado y duplicarlo, reduciendo así su calibre un 50%.5 Se basa en la separación en un plano avascular entre las dos láminas del mesenterio, inmediatamente subyacente a la pared intestinal, creado gracias a la disposición de los vasos, que no penetran en la pared exactamente en la línea media, sino a cada lado de ésta [5,6,9,10]. Luego se divide el intestino en sentido longitudinal, primero por su borde antimesentérico, y luego mesentérico, resultando en dos hemiasas, cada una con la mitad del diámetro del asa original.6 Finalmente se realizan tres anastomosis termino terminales para dejar el intestino en continuidad y en forma isoperistáltica, el intestino proximal a la hemiasa proximal, ambas hemiasas entre sí, y la hemiasa distal al intestino distal; adquiriendo forma de “S”.6,10,17 Está descripto el uso de máquina de sutura lineal cortante, haciendo el procedimiento más rápido, pero quedó en desuso por más riesgo de fístulas entero-enterales.9,16
El Bianchi exige requisitos de la anatomía del intestino remanente como son: una longitud mínima de entre 20 - 40 cm, y una dilatación mínima de 4 cm.16 Esto es así debido a que la reducción del lumen siempre es constante, un 50%. Por ejemplo; si contamos con una dilatación previa de 4cm, el diámetro final sería de 2 cm, siendo éste el límite inferior final sugerido del asa. En cuanto a la ganancia en longitud, permite duplicar la medida del asa elegida, siendo igual en todos los casos. Además solo se recomienda aplicarlo de forma primaria, una vez realizado no se podrá volver a repetir el procedimiento.11,15,16 Se considera una ventaja el no alterar la orientación de las fibras musculares de la pared intestinal.15
En cuanto al STEP, consiste en disparos con grapadora quirúrgica (stapler), secuenciales y alternados en direcciones opuestas, separados por 2 - 2.5 cm, perpendiculares al eje del intestino.11 A diferencia del LILT no exige un límite de longitud previa, pero sí una dilatación de entre 3.5 - 4 cm. Además en el STEP el porcentaje de reducción del diámetro y de elongación, no siempre es el mismo. El cirujano puede controlar la longitud final obtenida regulando la longitud del disparo transversal (determinado por el grado de dilatación previa), y por el número de disparos.11,15 La longitud final se puede calcular con la formula L + (S x N) (siendo L la medida del asa, S la medida del disparo y N el número de disparos).11 De esta manera, de tener una dilatación previa significativa, se puede llegar a superar el doble de la longitud del asa.11 Otras ventajas del STEP incluyen ser un procedimiento sencillo y más rápido, no requiere apertura del intestino ni manipulación del mesenterio, puede repetirse la técnica sobre un STEP previo o realizarse luego de un LILT, y es aplicable en el duodeno. 11,15,16 Como desventaja, se ha descripto que las múltiples líneas de sutura transversales pueden alterar la fisiología de las fibras musculares comprometiendo la peristalsis.6,15
El SILT se basa en la creación de un patrón de corte espiral a lo largo del intestino con un ángulo de 30 grados con respecto al eje longitudinal.12,18 Tiene utilidad en segmentos dilatados cortos, menos manipulación del mesenterio que el LILT, y mantiene la orientación longitudinal del de las fibras musculares, pero existe menos evidencia de los resultados con esta técnica.5,12
En los dos casos descriptos en este manuscrito, la razón fundamental por la que se optó por la técnica de Bianchi fue debido a que se contaba con los requisitos anatómicos de diámetro intestinal mayor de 4 cm, y longitud mayor de 20 - 40 cm. Dado que en estos casos la dilatación no superaba los 5 cm, no existía gran diferencia en cuanto a la longitud final que se pudiera lograr, ya que con cualquiera de las técnicas, esta no podría superar el doble de la longitud del asa. Además, la elección se respaldaba en el hecho de que el paciente no presentaba procedimiento de elongación previo. También influyó el poder desarrollar un procedimiento inédito en nuestro país, contando con el respaldo y asesoramiento técnico del Dr. Bianchi (creador de la técnica), quien supervisó la cirugía de forma remota para minimizar riesgos y asegurar un desenlace óptimo.
En cuanto a los resultados obtenidos con las diferentes técnicas, la evidencia existente se basa en reportes y series de caso.16 Ambas técnicas presentan similares porcentajes de independencia de la nutrición parenteral y sobrevida.19 El riesgo de complicaciones esta descripto en ambos procedimientos como falla de sutura, fuga de anastomosis, oclusión intestinal, estenosis, abscesos, perforación, o fístulas entero-enterales.16 En cuanto al LILT la complicación postoperatoria más temida, es la necrosis de las hemisas por interrupción del aporte sanguíneo.15) En cuanto al STEP presenta más de riesgo de sangrado por ulceración en zona de sutura con stapler, y de re-dilatación intestinal con necesidad de redo-STEP.6,16,17,20
Hemos presentado nuestra primera experiencia con la técnica de Bianchi en dos pacientes con SIC. Ambos casos fueron SIC tipo II, con dilatación yeyunal previa de entre 4 - 5 cm, y una longitud mayor de 20 - 40 cm, lo cual permitió aplicar la técnica de Bianchi. En ambos pacientes los resultados fueron satisfactorios, con ausencia de complicaciones, se logró independencia total de nutrición parenteral y se encuentran actualmente con un adecuado crecimiento pondoestatural y estado nutricional.















